 收集氧气
B .
收集氧气
B .  测定盐酸pH
C .
测定盐酸pH
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  蒸干滤液
蒸干滤液
| 选项 | 物质 | 除杂试剂(足量) | 操作方法 |
| A | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有烧碱溶液的洗气瓶 |
| B | NaCl(Na2CO3) | 盐酸 | 加入足量盐酸、蒸发、结晶 |
| C | NaCl(MnO2) | 水 | 加足量水溶解、过滤、洗涤、干燥 |
| D | Cu(CuO) | 氧气 | 通入足量氧气并加热 |
B .
B . 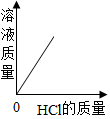
C .
C . 
D .
D . 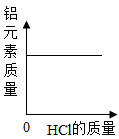
A 糖类 B 蛋白质 C 油脂 D 维生素 E 水 F 无机盐
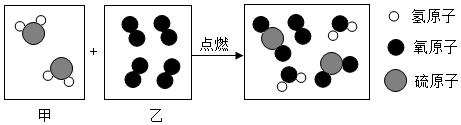
①天然气属于能源(填“可再生”或“不可再生”),其燃烧的化学反应方程式。
②若厨房失火时,移走“煤气罐”,这是利用了原理灭火(填字母序号)
A 清除可燃物 B 使可燃物与氧气隔绝
C 降低可燃物的着火点 D 降低温度
自来水是我国目前主要的生活饮用水.下表是我国生活饮用水的部分标准:
|
项目 |
标准 |
|
感官指标 |
无异味、异臭 |
|
化学指标 |
pH6.5﹣8.5,游离氯≥0.3mg/L﹣1 , 铁<0.3mg/L… |
①感官指标表现的是自来水的性质(填“物理”或“化学”)。
②化学指标中的pH=6.7时,表明自来水呈性。
③生活可用来区别硬水和软水,常用将硬水软化。
30℃时,硝酸钾的溶解度是。
60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是(填“饱和”或“不饱和”)溶液。
②将上述溶液降温至30℃,可析出硝酸钾晶体g,此时溶液的溶质质量分数(填“>”、“=”或“<”)45.8%。

①宏观表征:可以观察到的主要现象为,固体逐渐溶解;
②微观表征:如图2表示反应前后溶液中的主要离子,写出 ![]() 所表示的微粒符号;
所表示的微粒符号;
③符号表征:写出化学方程式。
①地壳中含量最多的金属元素是。在自然界中,大多数金属以化合物的形态存在,而金、铂却能以单质形态存在,这是因为。
②常见铁矿石有:赤铁矿(主要成分Fe2O3)、磁铁矿(主要成分Fe3O4)等。这两种矿石的主要成分含铁元素质量分数较大的是。
③日常生活中防止铁锅生锈的方法有(写一种)。

①图中只有乙实验没有明显现象,由此得出铜、铁、镍(Ni)在金属活动性顺序中的位置关系,活动性由强到弱的顺序是(填元素符号)。
②写出图中丙实验反应的化学方程式。
A 烤制食物时用的铝箔 B 铜导线 C 黄金首饰 D 打成薄金属片


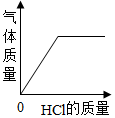
实验一:小组同学利用温度传感器测定了盐酸与氢氧化钠反应的时间-温度曲线如图1所示。


①由曲线变化情况分析可知,稀盐酸与氢氧化钠溶液发生反应并热量。
②400秒后,曲线开始呈下降趋势的原因是。
实验二:有同学提出还可利用pH的变化判断酸碱是否发生了反应,图 2所示是小组同学利用 pH传感器探究氢氧化钠溶液与稀盐酸反应的pH变化曲线。
③该反应是(填序号),M 点溶液中溶质为(填化学式)。
A 向氢氧化钠溶液中加入稀盐酸 B 向稀盐酸中加入氢氧化钠溶液

(提出问题)正极产生的刺激性气味的气体是什么?
(猜想与假设)猜想1:NH3;猜想2:HCl;猜想3:Cl2;猜想4:HCl和Cl2。
(讨论与交流)大家讨论后认为猜想1不合理,理论依据是。
①带有刺激性气味的气体有:HCl、Cl2、NH3等;
②Cl2与水反应生成氯化氢和次氯酸(HClO),氯气能与碘化钾反应生成氯化钾和碘,Cl2有毒且能溶于四氯化碳;
③碘能使淀粉溶液变蓝色;
④HCl不溶于四氯化碳,氯化银难溶于水。
(实验探究)如下图所示,将正极产生的气体依次通过湿润的碘化钾淀粉试纸、四氯化碳、硝酸银溶液、浓氢氧化钠溶液。

(实验现象)观察到装置B中,装置D中。
(实验结论)猜想3正确
实验结束,向装置A中的液体中滴入无色酚酞溶液,观察到溶液变红色,证明装置A中的液体显(填“酸性”碱性”或“中性”),由此实验可知氯化钠参加反应,电解氯化钠溶液的化学方程式为。
( )