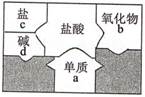

 B .
B .  C .
C .  D .
D . 
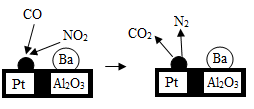
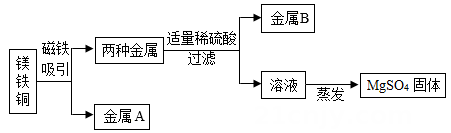
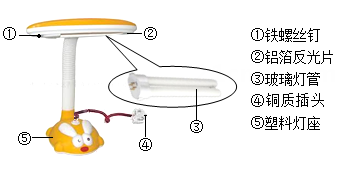

 B . 铜导线
B . 铜导线  C . 铜钟
C . 铜钟  D . 铜钱
D . 铜钱 
80克稀硫酸,分四次等质量加入,每次均充分反应,实验数据记录如下表。
|
实验次数 |
1 |
2 |
3 |
4 |
|
稀硫酸的用量/克 |
20 |
20 |
20 |
20 |
|
剩余固体的质量/克 |
20.0 |
17.4 |
14.8 |
13.8 |
分析上述数据,请回答下列问题:
①第4次实验结束后溶液的pH ▲ 7(填“>”、“=”或“<”)。
②计算铜钱中铜的质量分数(计算结果精确到0.1%)。
③计算参加反应的稀硫酸中的溶质质量(计算结果保留一位小数)。

①.鹰的飞翔 
②.蝴蝶扇动翅膀 
连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一.它的产品除了纯碱外,还有氧化钙和碳酸氢钠.该厂生产纯碱的工艺流程可简单表示如图1:

其生产过程中涉及到的主要化学反应有:
①NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓ ②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
请回答:
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是 ;干燥CO2气体,可用的干燥剂是 (填字母).
A.浓硫酸 B.固体氢氧化钠 C.生石灰
②实验室进行“过滤”操作时,下列说法正确的有 (填字母) .
A.使用的漏斗叫长颈漏斗 B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌 D.漏斗下端的管口要紧靠烧杯内壁
方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
方案二:用图2所示的装置,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是 ,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 .(装置气密性良好)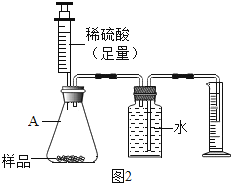
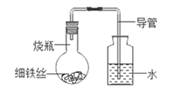
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到一定温度,可以得到一种外观似金子的锌和铜的合金,不法分子用它来冒充黄金.小晨同学在实验室进行了木炭粉还原氧化亚铜的实验(主要反应:C+Cu2O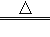 2Cu+CO↑),她观察到反应后的固体不完全是紫红色,于是对该固体的成分进行了实验探究:
2Cu+CO↑),她观察到反应后的固体不完全是紫红色,于是对该固体的成分进行了实验探究:
【提出问题】该固体的成分是什么?
【查阅资料】①Cu是紫红色固体
②Cu2O是红色固体
③Cu2O+H2SO4(稀)=CuSO4+Cu+H2O
猜想一:Cu
猜想二:Cu、Cu2O
猜想三:Cu、C
猜想四:Cu、Cu2O、C
小晨同学认为猜想 不正确,因为反应后的固体不完全是紫红色.
实验操作 | 实验现象 | 实验结论 |
步骤一:取少量固体置于烧杯中,加入足量稀硫酸,观察溶液颜色 | 溶液呈色 | 猜想三不正确 |
步骤二:把步骤一中所得混合物过滤,将滤渣干燥后置于滤纸上,观察固体颜色 | 固体为紫红色、黑色 | 猜想正确 |
【拓展延伸】
(1)从理论上看,碳与氧化亚铜的质量比应为1:12,但实际做实验时却将碳与氧化亚铜的质量比控制在约1:10.这样操作的理由是 .
(2)下列可以用于鉴别真、假黄金的方法是 (填字母).
A.观察颜色 B.加热固体 C.滴加稀硫酸 D.滴加硝酸银溶液.