 的名称为3一甲基丁烷
B . CH3CH2CH2CH2CH3和
的名称为3一甲基丁烷
B . CH3CH2CH2CH2CH3和  和
和  为同一物质
D . CH3CH2OH和
为同一物质
D . CH3CH2OH和 | X | Y | |
| Z | W |

| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法错误的是( )

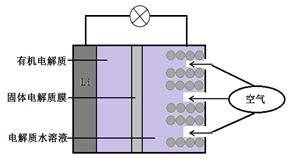

①X的化学式是。
②固体甲与稀硫酸反应的离子方程式是。
③热的氨气被固体X氧化成一种气体单质,该反应方程式。
①将FeSO4受热产生的气体按图示装置进行实验,证实含有SO2和SO3 , 能说明SO2存在的实验现象是:;

②为测定BaSO4沉淀的质量,后续的操作步骤依次为、洗涤、干燥、称量。
③试剂一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应):。
 +2FeCl3→
+2FeCl3→  +2FeCl2+2HCl
+2FeCl2+2HCl

在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
A.缓慢冷却溶液B.溶液浓度较高C.溶质溶解度较小D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可用玻璃棒摩擦容器内壁、等方法促进晶体析出。
A.无水乙醇B.饱和氯化钠溶液C.70%乙醇水溶液D.滤液

必须同时符合:①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。