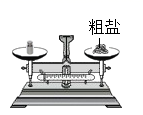
 B . 溶解粗盐
B . 溶解粗盐 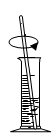 C . 过滤悬浊液
C . 过滤悬浊液  D . 蒸发滤液
D . 蒸发滤液 
 C . 2个钙离子;2Ca+2
D . 碱式碳酸铜:Cu(OH)2CO3
C . 2个钙离子;2Ca+2
D . 碱式碳酸铜:Cu(OH)2CO3
| 选项 | 目的 | 物质 | 主要实验操作 |
| A | 鉴别 | CO2和CO | 分别通入澄清石灰水,观察现象 |
| B | 检验 | CaO中是否含有CaCO3 | 取样,加入适量稀盐酸,观察现象 |
| C | 分离 | MnO2和KCl的混合物 | 溶解、过滤、洗涤并干燥滤渣,滤液蒸发结晶 |
| D | 除杂 | BaCl2溶液混有少量NaCl | 先加入过量Na2SO4溶液,过滤、洗涤;向所得固体中加入适量稀盐酸 |
a烤肉串 b苏式汤面 c珍珠奶茶 d凉拌马兰头
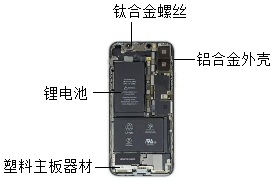
①选择钛合金作为螺丝材料,是因为合金的硬度比组成金属的硬度(填“大”或“小”)。
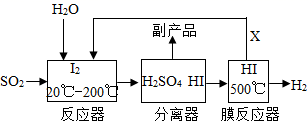
②工业上可通过下面两种方法制金属钛:
方法一:TiCl4在高温下与过量的Mg反应可制取金属钛,同时生成氯化镁。除去所得金属钛中混有的少量金属镁可用的试剂是。
方法二:高温条件下电解熔融的TiO2来制取金属钛,电解过程中需定期更换石墨电极,原因是。
①某锂电池放电时反应: ,能量转化形式为。电池级碳酸锂生产反应之一为氯化锂(LiCl)溶液与碳酸钠溶液发生复分解反应,该反应的化学方程式为。
②电池的电压与电池内部所发生的化学反应速率有关。如图是某锂电池手机在不同温度下的电压与待机时间的关系变化图像。当电压低于3.6V,手机会自动关机。请分析手机电池在冬天不耐用的原因是。

自热火锅、自热米饭的发热包主要成分一般是:生石灰、铁粉、铝粉、焦炭粉、活性炭、盐、焙烧硅藻土、氢化钙(CaH2)等。向发热包中加水,生石灰与水反应快速放热、金属粉、碳粉、盐等物质相互反应持续放热。硅藻土孔隙较大,可起到缓冲反应的作用,为发热包的安全性提供保障。氢化钙能与水反应(生成氢氧化钙和氢气)用来吸收渗入包装内的微量水分,防止氧化钙逐渐失效。
发热剂成分不同,发热效果不同。下表为不同发热剂(30g)对不同食物的加热效果表(加热时间为5min),下图为自热米饭在不同测温点的温度变化曲线。
|
发热剂 |
理论放热量/kJ |
矿泉水(250g) |
八宝粥(250g) |
||
|
△T/℃ |
吸热量/kJ |
△T/℃ |
吸热量/kJ |
||
|
H2O+MgCl2 |
43.48 |
25 |
26.17 |
22 |
20.14 |
|
H2O+AlCl3 |
73.29 |
38 |
39.77 |
32 |
29.31 |

使用加热包的注意事项:①加热前,将自热锅盖上的透气孔打开,加入冷水;②发热包中反应较为复杂,会产生一定量的氢气和一氧化碳,不能在汽车等密闭、狭小环境中使用,使用时避免明火;③使用后的发热包按有害垃圾分类处置。
a高铁车厢内可以多人同时制作不同口味的自热火锅
b为快速使自热火锅升温,应密封锅盖上的透气孔
c自热米饭“自热”后保温时间极短,“自热”后需立即食用
d等质量的MgCl2和AlCl3作发热剂为相同食物加热时,AlCl3“发热”效果更好


①关闭止水夹K,通入氢气并点燃。为保证安全,点燃氢气之前应先。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开止水夹K,通入氧气。火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与氧气的有关。
①碳酸钙与稀盐酸反应的化学方程式为。要确认碳酸钙与稀盐酸反应后的残留液中是否有盐酸剩余,下列方案中不可行的是(填序号)。
a取样,加入少量锌粒,观察是否有气泡产生
b取样,滴加少量碳酸钠溶液,观察是否有气泡产生
c取样,滴加少量硝酸银溶液,观察是否产生沉淀
d取样,滴加少量紫色石蕊溶液,观察溶液是否变红
②脱脂棉燃烧是因为Na2O2与CO2反应生成了Na2CO3和,且该反应(填“吸收”或“释放”)热量。
|
编号 |
实验操作 |
实验现象 |
|
① |
取5mL3%H2O2溶液于试管中,观察现象 |
无明显气泡产生 |
|
② |
取5mL6%H2O2溶液于试管中,观察现象 |
无明显气泡产生 |
|
③ |
取5mL3%H2O2溶液于试管中,滴2滴FeCl3溶液 |
有明显气泡产生 |
|
④ |
取5mL3%H2O2溶液于试管中,滴2滴FeCl3溶液,放入盛有40℃热水中没泡 |
有明显气泡,放入热水后气泡量增大 |
查阅资料:氯化铁能催化过氧化氢分解。

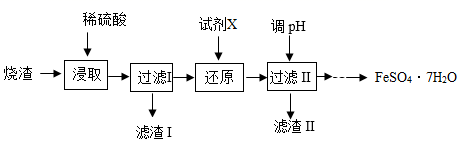
已知:①焙烧过程主要反应为:
②Fe3+、Al3+、Fe2+在溶液中开始沉淀至沉淀完全的pH值如下表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.1 | 3.5 | 6.5 |
| 沉淀完全的pH | 3.2 | 4.7 | 9.7 |
a将烧渣粉碎 b降低硫酸的浓度 c快速搅拌
(查阅资料)
①碳酸氢钠的溶解度如下:
|
温度 |
10℃ |
20℃ |
30℃ |
40℃ |
|
溶解度 |
8.1g |
9.6g |
11.1g |
12.7g |
②碳酸氢钠固体在潮湿的空气中久置或受热分解均生成 Na2CO3、H2O和CO2。
(实验探究)
探究1:NaHCO3溶液与盐酸反应的热效应
室温下(20℃),边搅拌边向盛有0.5 g NaHCO3固体的烧杯中加入10mL水,测得温度为18.5℃;恢复至室温后,向烧杯中加入过量10mL质量分数为20%的盐酸(20℃),搅拌,测得温度为20.8℃。
探究3:久置的 NaHCO3样品中 NaHCO3含量的测定:
将一瓶在潮湿空气中久置的 NaHCO3样品(假设只有NaHCO3和Na2CO3)混合均匀后,称取19.0g混合物,加热至恒重,称其质量为15.9g。
②若上述测定过程中未加热至恒重,则测得 NaHCO3的质量分数将(填“偏大”、“偏小”或“无影响”)。