
 可从中药材当归 和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
可从中药材当归 和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
| A | B | C | D |
| | | | |
| 混合浓硫酸和乙醇 | 验证SO2的漂白性 | 蒸干MgCl2溶液制取无水MgCl2 | 充分振荡后下层为无色 |



回答下列问题:
 )在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得:
)在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得: 已知:纯乙酰苯胺是白色片状晶体,熔点为114℃;微溶于冷水,可溶于热水,易溶于有机溶剂;加热时易被氧化。
实验室制备乙酰苯胺的步骤如下(部分装置省略):
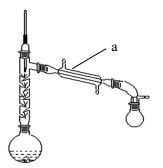
Ⅰ.粗乙酰苯胺的制备
在150mL 烧瓶中加入15mL(过量)乙酸(沸点117.9℃)、少量Zn粉和10mL(0.11mol)新制得的苯胺,如图接好装置。在石棉网上用小火加热,控制顶端馏出温度105℃左右使之充分反应1h。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移入500mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为11.2g。
回答下列问题:
A.乙醇 B.CCl4 C.冷水 D.乙醚
②2NH3(g)+2O2(g)=N2O(g)+3H2O(g) ΔH2
③2N2O (g)=N2O(g)+ O2(g) ΔH3
上述反应ΔH1、ΔH2、ΔH3之间的关系式为ΔH3= 。

①图中X点所示条件下,反应 达到平衡(填“已经”或“未”)。
②2NO(g)+O2(g) ⇌2NO2(g) ΔH0(填“>”或“<”)。
第一步 2NO⇌N2O2 快速平衡
第二步 N2O2+O2→2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是______ (填标号)
①t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为25%,则NO2分压为,(分压=总压×物质的量分数),反应N2O4(g) ⇌2NO2(g)的平衡常数Kx= (对于气相反应,用某组分B的物质的量分数x(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kx)。
②若提高反应温度至315K,且在恒压情况下反应达到平衡,则N2O4气体的平衡转化率25%(填“>”“=”“<”),原因是 。
 中的大π键应表示为。
中的大π键应表示为。

 外的官能团名称为。
外的官能团名称为。
 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)