
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 向某无色溶液中通入过量的CO2气体 | 有白色沉淀产生 | 该溶液中一定含SiO |
| B | 向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加入NaOH溶液至碱性,加入少量碘水 | 溶液未变蓝 | 淀粉已完全水解 |
| C | 将带火星的木条和加热至液态的钠分别伸入盛有NO2的集气瓶中 | 木条不复燃,钠燃烧 | NO2的助燃性具有选择性 |
| D | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无NH |

已知:H2NCH2CH2NH2+H2O⇌[H2NCH2CH2NH3]++OH-
下列说法正确的是( )

![]()
部分物质相关性质如下表:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
| 2-硝基-1, 3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取77.0 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15 min(如图1)。
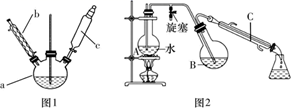
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。
请回答下列问题:
A.30~60℃ B.60~65℃
C.65~70℃ D.70~100℃

已知:LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
|
容器编号 |
物质的起始浓度(mol/L) |
物质的平衡浓度(mol/L) |
||
|
c(NO2) |
c(NO) |
c(O2) |
c(O2) |
|
|
I |
0.6 |
0 |
0 |
0.2 |
|
Ⅱ |
0.3 |
0.5 |
0.2 |
|
①容器Ⅱ在反应的起始阶段向(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为
A.>1 B.=1 C.<1


①曲线a中,NO的起始浓度为6×10-4 mg·m-3 , 从A点到B点经过0.8 s,该时间段内NO的脱除速率为mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是。

①从A口中出来的物质的是。
②写出电解池阴极的电极反应式。
③用离子方程式表示吸收池中除去NO的原理。
①与KSCN中与SCN-互为等电子体的非极性分子的化学式为
②SCN-中碳原子杂化类型为。
①含有-CONH2;②能与FeCl3溶液发生显色反应;③核磁共振氢谱的吸收峰数目有4个。
 )的合成路线:。
)的合成路线:。