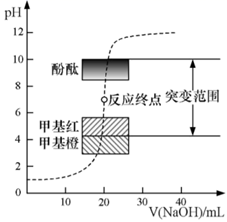
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
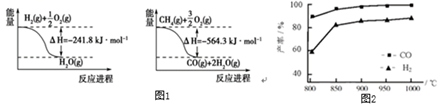
①根据键能计算,该反应的
。
| 化学键 | C-H | C=O | H-H | |
| 键能kJ/mol | 413 | 745 | 436 | 1075 |
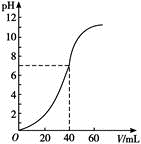
②按一定体积比加入 和
,在恒压下发生反应,温度对CO和
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是。
③某温度下,将 、
以及催化剂进行加入
容器中,达到平衡时
,平衡常数
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖:
1918年弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得诺贝尔化学奖,
1931年卡尔·博施因改进合成氨的方法获得诺贝尔化学奖,
2007年格哈德·埃特尔因发现了哈伯-博施法合成氨的作用机理获得诺贝尔化学奖。 和
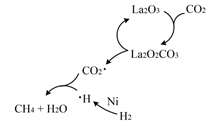
在固体催化剂(Fe)表面合成氨的过程可用下图表示:
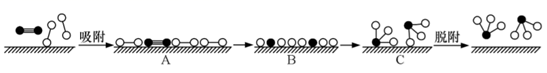
(图中 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 分别表示
分别表示 、
、
和固体催化剂);反应历程如下(*表示吸附态):
吸附: ;
。
表面反应: ;
;
。
脱附: 。
其中, 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。

①有利于提高 平衡转化率的方法有(填字母)。
A.增大 的浓度 B.采用合适的催化剂
C.在高压下进行反应 D.在较高温度下进行反应
②其他条件相同,不同压强下在刚开始反应时反应物活化分子浓度较大的是(填“ ”、“
”或“
”)。
①从化学平衡角度看, 和
物质的量之比为1:3时平衡转化率最高。请分析实际生产中适当提高原料气中
比例的两个理由:、。
②据悉,日本某工厂选择了在700℃下合成氨,请(从化学动力学的角度)分析该厂选择合成温度为700℃的理由:。
③工业生产中同时还采用“不断将氨液化并移去液氨”的措施来提高合成氨产率,请分析采取该措施的原因:。
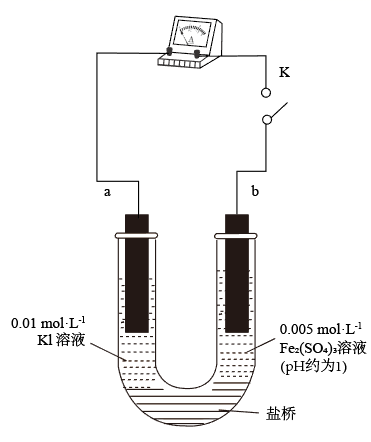
①K闭合时,指针向右偏转,b作极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是。
①转化原因是。
②与(3)实验对比,不同的操作是。
以硫酸镍( )为原料制备
的主要过程如下图所示。制备过程中,降低
沉淀速率,可以避免沉淀团聚,提升电池性能。
![]()
已知:
制备过程中,需先加氨水,再加过量NaOH,请分析:
①先加氨水的目的是,用化学平衡移动原理分析加入NaOH需过量的原因。
②主要步骤:①将 (内含增强导电性的石墨粉)和
(内含防结块的氧化铁粉)固定,中间用隔膜隔成阴极室和阳极室(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
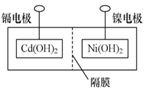
下列对镍镉电池组装和使用的分析正确的是_______(填字母)。
III.池充电时,若 和
耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的
可对电池进行过度充电保护,该方法称为镉氧循环法。