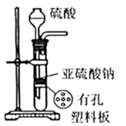
 B . 干燥
B . 干燥  C . 收集
C . 收集  D . 吸收
D . 吸收 
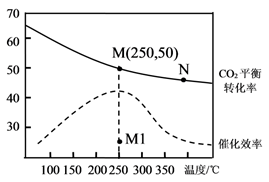
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把能转化为能的装置。
②工业制备纯硅的反应: ,生成的
通入
的
溶液恰好反应,则制备纯硅的过程中(填“吸收或“释放”)的热量为
。
①在 下,
氢气完全燃烧生成液态水放出
的热量。写出表示氢气燃烧热的热化学方程式。
②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
;
则
。
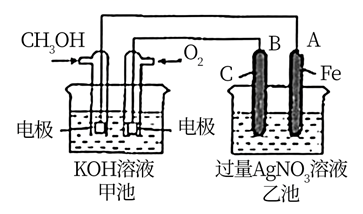
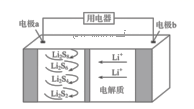
①乙池是装置(填“原电池”或“电解池”),A电极的名称是;B(石墨)电极的电极反应式为:。
②甲池中通入 一极的电极反应式为:。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入(填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:。
| | 400 | 300 |
| 平衡常数K | | |
①试判断
(填写“>”=”或“<”)。
②下列能说明该反应已达到平衡状态的是(请将答案填涂在答题卷相应位置)。
a.容器内 的浓度之比为
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
e.断裂 的同时,有
生成
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是
a.采用较高温度 b.将生成的氨液化并及时从体系中分离出来
c.用铁触媒加快化学反应速率 d.采用较高压强
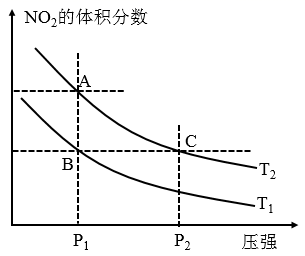
a. 两点的反应速率:
b. 两点的气体的平均相对分子质量:
c. 两点
的转化率:
d.由状态B到状态A,可以用加热的方法
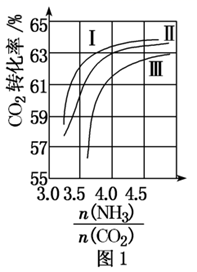
①曲线I、Ⅱ、Ⅲ水碳比的数值分别为A. ;B.
;C.
生产中应选用水碳比的数值为(填字母)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是。
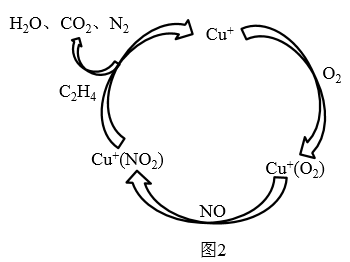
①目前,科学家正在研究一种以乙烯作为还原剂的脱硝 原理,其脱硝机理示意图如图2,按照机理写出该脱硝原理总反应的化学方程式:。
②某研究小组在实验室以 为催化剂,测得
转化为
的转化率随温度变化情况如图3所示。
若不使用 ,温度超过
,发现
的分解率降低,其可能的原因是;在
的条件下,应控制的最佳温度在左右。


a. 时,溶液中含碳元素的微粒主要是
b.A点,溶液中 和
浓度相同
c.当 时,
②向上述 的水溶液中加入
溶液时发生反应的离子方程式是。
|
弱酸 |
|
|
|
|
电离平衡常数 |
|
|
|
按要求回答下列问题:
① 的酸性由强到弱的顺序为。
②将少量 气体通入
溶液中,写出该反应的离子方程式:。
①常温下, 溶液的
;
② 的
与
的
溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:。
I.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度,将水样与 碱性悬浊液(含有
)混合,反应生成
,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被
还原为
,在暗处静置
,然后用标准
溶液滴定,生成的
反应为:
。
回答下列问题: