 硅太阳能电池
B .
硅太阳能电池
B .  锂离子电池
C .
锂离子电池
C .  太阳能集热器
D .
太阳能集热器
D .  燃气灶
燃气灶
 B . 干燥NH3
B . 干燥NH3 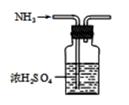 C . 收集NH3
C . 收集NH3  D . 喷泉实验装置
D . 喷泉实验装置 

| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验 |
| D | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| 测定时刻/s | | | | |
| | 6 | 3 | 2 | 2 |
| | 5 | 3.5 | 3 | 3 |
| | 1 | 2.5 | 3 | 3 |



①装置A产生SO2 , 反应的化学方程式为。
②按气流方向连接各仪器接口,顺序为a→→→→→f,装置E中NaOH溶液的作用是吸收多余的SO2 , 该反应的离子方程式为。
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。


表示NO2浓度变化的曲线是,写出相应的化学方程式:。
|
序号 |
锌的质量/g |
锌的状态 |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
反应前溶液的温度/℃ |
其他试剂 |
|
1 |
0.65 |
粒状 |
0.5 |
50 |
20 |
无 |
|
2 |
0.65 |
粉末 |
0.5 |
50 |
20 |
无 |
|
3 |
0.65 |
粒状 |
0.5 |
50 |
20 |
2滴CuSO4溶液 |
|
4 |
0.65 |
粉末 |
0.8 |
50 |
20 |
无 |
|
5 |
0.65 |
粉末 |
0.8 |
50 |
35 |
2滴CuSO4溶液 |
在此5组实验中,速率最快的是(填实验序号);实验1和2表明对反应速率有影响;实验1和3表明对反应速率有影响。

则电极d是(填“正极”或“负极”),电池总反应式为。
素材1:某温度和压强下,2升密闭容器中,不同时间点测密闭体系中三种物质的物质的量
|
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的物质的量分数,SO2的转化率越大,化学反应的限度越大)
| | 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 ℃ | 73.7 | 85.8 | 90.0 | 96.4 |
根据两个素材回答问题:
①混合气体的压强 ②混合气体的密度
③混合气体的总物质的量 ④混合气体的平均相对分子质量