A | B | C | D |
|
|
|
|
冰墩墩的PVC(聚氯乙烯)外壳 | “飞扬”火炬中的碳纤维树脂复合材料 | 首钢大跳台的“钢” | 颁奖礼服中的石墨烯 |
①升高温度 ②改用18mol/L硫酸 ③加入少量CuSO4溶液 ④加入几滴浓HNO3 ⑤将Zn粒换成Zn粉 ⑥通入少量HCl气体
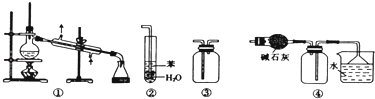
选项 | 操 作 | 现 象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
C | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在 |
D | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |



生成1 mol NO(g) ( 填“吸收"或“放出") kJ 的热量。
t/min | 0 | 3 | 6 | 12 | 24 | 36 |
n甲(CH3OH)/mol | 0 | 0.36 | 0.60 | 0.82 | 0.80 | 0.80 |
n乙(CH3OH)/mol | 0 | 0.30 | 0.50 | 0.68 | 0.85 | 0.85 |
①T1T2(填“>”“<”或“=”)。
②甲容器中,0 ~6 min内的平均反应速率v(H2)= 。
③甲容器中CO2的平衡转化率为

①电极a为极(填“正”或“负")。
②电极b发生的电极反应为。
 , 汞在第周期。
, 汞在第周期。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_Al2O3+_N2+_C—_AlN+_CO

①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为。
①加入过量的溶液
②加入过量的溶液
③加入过量的NaOH溶液
④加入盐酸调节溶液至中性
⑤溶解
⑥过滤
⑦蒸发
正确的操作顺序是____(填字母)。

F的结构简式是。

G的分子式为。