 B . 氟利昂(
B . 氟利昂(  )是甲烷的氯、氟代物,它共有两种同分异构体
C . 戊烷分子中的极性键与非极性键个数比为3∶1
D . CH3OH、
)是甲烷的氯、氟代物,它共有两种同分异构体
C . 戊烷分子中的极性键与非极性键个数比为3∶1
D . CH3OH、 

| 序号 | 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| ① | 把SO2和气体X一起通入到BaCl2溶液中 | 有白色沉淀产生 | X气体具有强氧化性 |
| ② | 向溶液Y中加入浓氢氧化钠溶液并加热 | 有气体产生,该气体使湿润的红色石蕊试纸变蓝 | 溶液Y一定是铵盐溶液 |
| ③ | 过量铁粉加入稀硝酸中,充分反应后,滴加KSCN溶液 | 有无色气泡产生,溶液呈血红色 | 稀硝酸能将Fe氧化成Fe3+ |
| ④ | 向某溶液中加入稀硫酸 | 生成淡黄色沉淀和能使品红溶液褪色的刺激性气味的气体 | 该溶液中一定含有S2O |

对图中有关物质及反应的叙述正确的是( )

a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
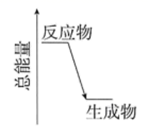
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和。

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为(填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为。
①甲在相同条件下沸点最高,甲的结构简式是。
②乙的一氯代物共有4种,乙的名称是。
③丙的所有H化学性质完全相同,写出丙与Cl2按照1:1的比例发生反应的化学方程式: 。
④键线式是以线表示共价键,每个折点或端点表示一个碳原子,并省略书写氢原子的一种表示有机化合物结构的式子,如异丁烷( ![]() )可表示为“
)可表示为“ ![]() ”,请分析这一表示方式的要领,写出乙的键线式:。
”,请分析这一表示方式的要领,写出乙的键线式:。
|
时间/min |
1 |
2 |
3 |
4 |
5 |
|
氢气体积/mL |
50 |
112 |
232 |
280 |
310 |
a.加热 b.加入1 mol/L的硫酸 c.加入少量CuSO4固体 d.把锌粒磨成锌粉
|
实验混合溶液 |
A |
B |
C |
|
4 mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
|
H2O/mL |
10 |
V3 |
V4 |
|
t/s |
t1 |
t2 |
t3 |
①请完成该实验设计:V1=,V4=。
②实验结果t3>t1>t2 , 试解释t1>t2的原因:, t3>t1的原因:。

NH3的发生装置应选择图中的(填字母代号),制备NH3的化学方程式为。

实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是(填“吸热”或“放热”)反应,反应的化学方程式是。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为。

①烧渣中的FeS在反应中作剂(填“氧化”或“还原”)。
②溶液I中所含溶质的化学式是。
A.混合气体的质量不再变化 B.SO2与O2的物质的量比例不变
C.气体密度不再变化 D.气体的平均相对分子质量不再变化
E.SO2的消耗速率与O2的生成速率之比为1:2
若将模拟反应容器中的气体通入到酸性高锰酸钾溶液中,可以恰好使200 mL3 mol/L的高锰酸钾溶液褪色,则模拟反应器中SO2的转化率为。