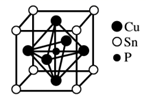
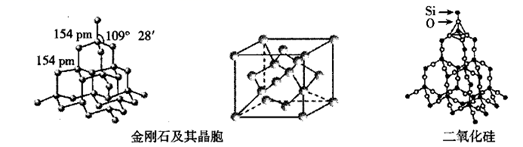
| 叙述Ⅰ | 叙述Ⅱ | |
| A | SiO2晶体熔点高、硬度大 | SiO2晶体可用于制造光导纤维 |
| B | 碘晶体中的I―I键能较小 | 晶体碘沸点低、易升华 |
| C | NaCl晶体中Na+与Cl-个数比为1:1, CsCl晶体中Cs+与Cl-个数比也为1:1 | NaCl和CsCl的晶胞结构相同 |
| D | 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构 | 金刚石和硅晶体类型相同 |
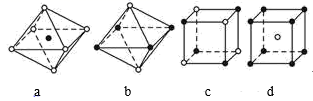
|
A组 |
B组 |
C组 |
D组 |
|
金刚石:3550 ℃ |
Li:181 ℃ |
HF:-83 ℃ |
NaCl:801 ℃ |
|
硅晶体:1410 ℃ |
Na:98 ℃ |
HCl:-115 ℃ |
KCl:776 ℃ |
|
硼晶体:2300 ℃ |
K:64 ℃ |
HBr:-89 ℃ |
RbCl:718 ℃ |
|
二氧化硅:1723 ℃ |
Rb:39 ℃ |
HI:-51 ℃ |
CsCl:645 ℃ |
据此回答下列问题:
①有金属光泽 ②导电性 ③导热性 ④延展性
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
|
物质 |
熔点/℃ |
沸点/℃ |
|
As2O3 |
175 |
457.2(193℃时升华) |
|
MgO |
2800 |
3600 |
|
Na2O |
1275 |
1950 |
三种物质中,MgO熔点最高的原因是 。
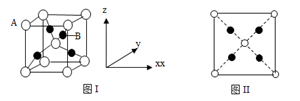

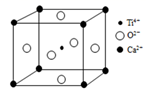
|
A组 |
B组 |
C组 |
|
金刚石:3550 |
| |
| 硅晶体:1410 | | |
| 硼晶体:2300 | | |
| 二氧化硅:1732 | | |
据此回答下列问题:
①A组属于晶体,其熔化时克服的粒子间的作用力是;
②硼晶体的硬度硅晶体的硬度(填“大于”“小于”)。
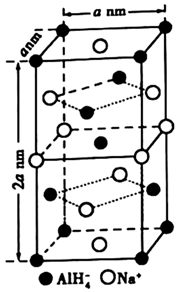
晶体中,与
紧邻且等距的
有个;
晶体的密度为
(用含a的代数式表示)。若
晶胞底心处的
被
取代,得到的晶体为(填化学式)。