 )的说法正确的是( )
)的说法正确的是( )
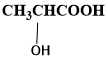 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C . 许多过渡金属离子对多种配体具有很强的结合力,因而只有过渡金属才能形成配合物
D . BF3是含极性键的非极性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C . 许多过渡金属离子对多种配体具有很强的结合力,因而只有过渡金属才能形成配合物
D . BF3是含极性键的非极性分子
①塑料、合成纤维和合成橡胶是应用广泛的高分子材料
②用灼烧的方法可以区别蚕丝和棉花
③纤维素和淀粉都是多糖,二者互为同分异构体
④利用牛油和植物油在碱性条件下的水解反应可以制造肥皂
⑤糖类、油脂和蛋白质在一定条件下都能水解
⑥在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
⑦天然植物油常温下一般呈液态,难溶于水,属于混合物,没有恒定的熔点和沸点
⑧欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
| 选项 | 实验操作 | 实验目的 |
| A | 向电石中滴加饱和食盐水,将产生的气体通入溴水 | 检验产生的乙炔气体 |
| B | 乙醇与浓硫酸混合加热至170℃,将产生的气体先通入NaOH溶液,再通入Br2的CCl4溶液 | 检验产生的乙烯气体 |
| C | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 验证酸性:盐酸>碳酸>苯酚 |
| D | 向盛有2mL鸡蛋清溶液的试管中滴加数滴浓硝酸,微热 | 检验蛋白质具有碱性 |

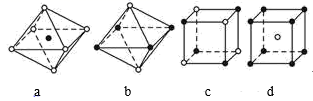
 ,镍原子的配位数为12
,镍原子的配位数为12

a. 分子中氮原子的杂化轨道类型为sp2杂化
b. 其结构式为F-N=N-F
c. 其分子有两种不同的空间构型
d. 1 mol N2F2含有的σ键的数目为4NA(NA表示阿伏加德罗常数的值)

①磷化铝的晶体类型为。
②A、B点的原子坐标如图所示,则C点的原子坐标为。
③磷化铝的晶胞参数a=546.35 pm(1 pm=10-12m),其密度为g/cm3。(列出计算式即可,用NA表示阿伏加德罗常数的值)


①晶胞中镍原子的堆积模型名称是。
②元素铜与镍的第二电离能分别为:I2(Cu)=1959 kJ/mol,I2(Ni)=1753 kJ/mol,I2(Cu)>I2(Ni)的原因是。
③若合金的密度为d g/cm3 , 晶胞参数(即边长)a=nm。(用NA表示阿伏加德罗常数的值)
①核磁共振氢谱为3组峰;
②能使溴的四氯化碳溶液褪色;
③1 mol该同分异构体与足量饱和NaHCO3溶液反应产生88 g气体。