| 序号 | ① | ② | ③ | ④ | ⑤ |
| 仪器 | | | | | |
 )中存在共价键
C . 新型原电池材料磷酸盐Li1﹣xFePO4中Fe显+2价
D . 离子结构示意图为
)中存在共价键
C . 新型原电池材料磷酸盐Li1﹣xFePO4中Fe显+2价
D . 离子结构示意图为  的粒子能表示35Cl﹣或37Cl﹣
的粒子能表示35Cl﹣或37Cl﹣
| 选项 | 实验 | 现象 | 结论 |
| A | 将铝丝和铜丝接触,并放入冷的浓硝酸中浸泡一段时间 | 铝丝上有红棕色气体产生 | 形成了原电池,且负极反应为Cu﹣2e﹣═Cu2+ |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 向某溶液中加入稀硝酸酸化的Ba(NO3)2溶液,再加入AgNO3溶液 | 开始无现象,后有沉淀生成 | 原溶液中一定含有Cl﹣ |
| D | 将盐酸和大理石反应生成的CO2气体直接通入Na2SiO3溶液中 | 产生白色沉淀 | 证明酸性:碳酸>硅酸 |




| a | b | c |
| d | e |
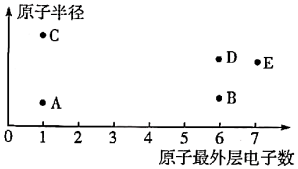
a.E的简单氢化物的稳定性比D的强
b.D的氧化物对应的水化物的酸性比E的弱
c.D的单质常温下为固体,E的单质常温下为气体
d.将E的单质通入D的简单氢化物的水溶液中,有D的单质生成
①产生H2的平均反应速率最大的时间段是(填“0~2min”“2~4min”或“4~6min”),该时间段内对反应速率起关键作用的影响因素是。
②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是。
③要加快上述实验中产生氢气的速率,还可采取的措施是(填一种)。
①分解海水的反应属于“反应(填“放热”或“吸热”)。
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为NaHCO3+H2 HCOONa+H2O。下列说法正确的是(填序号)。
A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键、非极性键的断裂
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1molH2O放出2.24LH2


|
电池装置 |
| | | |
| 编号 | a | b | c | d |
①上述四种电池中,属于二次电池的是(填序号,下同),属于干电池的是。
②a装置中,外电路中电子的流向是。(填“从Zn流向Cu”或“从Cu流向Zn”)
③装置中,若电解质改为碱性介质,则负极的电极反应式为。
①该电池的电解质溶液可以是。
②当外电路中转移1mole﹣时,电解质溶液增加的质量是g。

|
化学键 |
H﹣H |
N﹣H |
N≡N |
|
能量 |
436kJ |
391kJ |
946kJ |
生成1molNH3时,合成氨反应(填“吸收”或“放出”)的能量是kJ。

①反应开始10min内,N2的平均反应速率为。
②下列判断正确的是。(填序号)
A.tmin时正、逆反应速率相等
B.Z曲线表示NH3的物质的量随时间变化的情况
C.0~10min内v(H2)= v(NH3)
D.10~20min内的反应速率比0~10min内的反应速率大
③25min时,改变的一种条件是。