 B . 比较Ksp( AgCl)和Ksp(AgI )的大小
B . 比较Ksp( AgCl)和Ksp(AgI )的大小  C . 制备并收集干燥的NH3
C . 制备并收集干燥的NH3  D . 制取和收集少量CO2、NO和O2
D . 制取和收集少量CO2、NO和O2 

| 选项 | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液 | 探究浓度对反应速率的影响 |
| C | 常温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaF溶液和NaClO溶液的pH | 比较HF与HClO的酸性强弱 |
| D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成红棕色的NO2能溶于浓硝酸 |


 )广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( ) 

①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入盐酸后沉淀不溶解;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定存在的离子组是( )

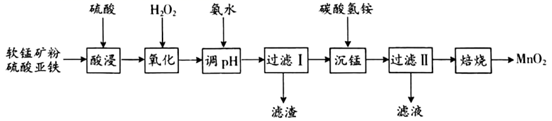
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
①“沉锰”过程中放出CO2 , 反应的离子方程式为。
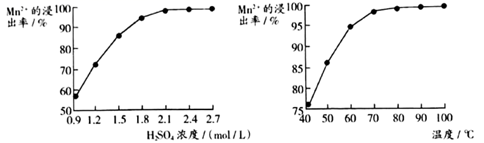
②“沉锰”过程中沉锰速率与温度的关系如图所示。

当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是。
已知:①常温下ClO2为黄绿色气体,其熔点为-59℃,沸点为11.0℃,能溶于水,不与水反应。②温度过高,ClO2的水溶液可能爆炸。
实验室利用如图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2 , 并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。

步骤1:准确量取ClO2溶液20.00 mL,稀释成100.0 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用a mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
已知:2ClO2+8H++10I-=5I2+2Cl-+4H2O I2+2Na2S2O3=2NaI+Na2S4O6
①步骤I中量取20.00 mL ClO2溶液所用的仪器为(选填“酸式"或“碱式”)滴定管。
②指示剂x为,滴定终点的实验现象是。原ClO2溶液的浓度为g/L(用含字母的代数式表示)。

①烧瓶中发生反应的氧化剂和还原剂的物质的量之比为。
②装置B中的现象可以说明氧化性>,从原子结构的角度解释。

①装置E、F分别盛放和。
②E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通入氮气的作用是。

①反应I、反应II与反应III中催化剂效果最佳的是(选填“反应I”“反应II”或“反应III”)。
②若此反应在a点时达到化学平衡状态。则此时该反应的化学平衡常数为。(计算结果保留到小数点后一位)