 D . NaOH的电子式为
D . NaOH的电子式为 ①减少化石燃料的使用②烟气催化脱硝处理③使用强氧化剂氧化脱氮④用生石灰改良酸性土壤





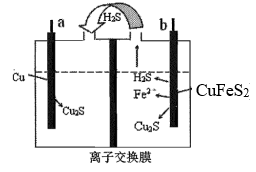
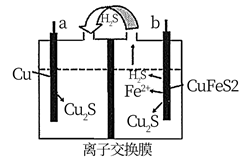
| 实验 | 实验操作 | 实验现象 |
| 1 | 用pH试纸测定0.1mol·L-1NH4HCO3溶液的pH | pH约为8 |
| 2 | 向0.1mol·L-1NH4HCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液 | 析出白色沉淀 |
| 3 | 常温下,将等体积等物质的量浓度NH4HCO3与NaCl溶液混合 | 析出晶体 |
| 4 | 向0.1mol·L-1NH4HCO3溶液中加入0.1mol·L-1AlCl3溶液 | 有气泡产生 |
下列有关说法正确的是( )

反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)△H2
下列说法正确的是( )

②Fe2+基态核外电子排布式为。

已知:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4

①Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4 , 发生的主要反应的离子方程式为。
②Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为。

 已知:Boc—表示
已知:Boc—表示 
①分子中含有—NH2;
②核磁共振氢谱有四组峰
③能发生银镜反应:常温下1mol最多与含4molNaOH水溶液完全反应。
 为原料制备
为原料制备  的合成路线(无机试剂和有机试剂任用,合成路线示例见本题题干)。
的合成路线(无机试剂和有机试剂任用,合成路线示例见本题题干)。

②合成过程中需控制 ≈
,比理论值
略大的原因是。
实验中可选用的试剂:5mol•L-1水合肼溶液、2mol•L-1硫酸、2mol•L-1NaOH溶液、铜氨废液、蒸馏水。
已知:2[Cu(NH3)4]2++N2H4•H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O。
