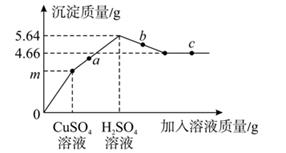
B . 向一定质量的稀硫酸中滴加水
B . 向一定质量的稀硫酸中滴加水  C . 向氯化铁和盐酸的混合溶液中滴加氢氧化钠溶液至过量
C . 向氯化铁和盐酸的混合溶液中滴加氢氧化钠溶液至过量  D . 高温煅烧一定质量的石灰石
D . 高温煅烧一定质量的石灰石 
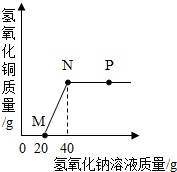
①取少量该粉末置于烧杯中,未嗅到任何气味;向烧杯中加入适量的水,充分搅拌,静置后,观察到上层溶液呈无色,烧杯底部有蓝白色固体;过滤.
②向上述滤液中滴加几滴硝酸银溶液,溶液变浑浊.
③将上述滤渣投入盛有足量稀盐酸的烧杯中,充分搅拌,有无色无味的气体产生.烧杯底部有白色固体剩余.
则下列说法正确的是( )
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,广泛应用于实际生产和生活中.在工业上,制取氯气的主要工艺流程如下:

(1)熟石灰可由生石灰溶于水制得,反应的化学方程式是: .测量其溶液的pH时,可以 ,再用标准比色卡比较试纸显示的颜色,读取该溶液的pH.
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是: .
(3)用熟石灰来改良酸性土壤,反应的化学方程式是: (以土壤中含有硫酸为例).
(4)用熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合可制得高效环保农药“黑白粉”.使用时,选择在有露水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体.
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的KOH,反应的化学方程式是 .
②“黑白粉”还可提供植物必需的营养素是 (填元素符号).
多角度认识物质的变化,有助于我们更好地理解化学知识.
(1)从微观角度(图1为某化学反应的微观示意图,据图回答下列问题.)

①微观上看,该化学变化中发生根本改变的微粒是 (填“原子”或“分子”),变化过程中,同种原子的个数 (填“有”或“没有”)增减.
②参加反应的A2与B2两种物质的分子个数比为 .
(2)从反应类型角度
(一种物质可通过不同的反应类型生成,以二氧化碳为例.)
①能与氧气化合生成二氧化碳的物质是 (填一种物质化学式).
②高温下,石灰石分解生成二氧化碳的化学方程式是 .
③在一定条件下,碳与铁的氧化物能发生置换反应,生成二氧化碳和 (填化学式).
(3)从能量变化角度
(借用图2装置分别进行进行下列实验,认识物质变化中的能量变化)
①往烧杯中加入一定量生石灰会引起白磷燃烧,从燃烧条件分析,此时生石灰的作用是 .写出生石灰与水反应的化学方程式 .
②将一定量的下列某物质溶于烧杯中的冷水,其中能引起白磷燃烧的是 (填标号).
A.氯化钠 B.硝酸铵 C.浓硫酸 D.氢氧化钠.
猜想Ⅰ:全部是金属铜;
猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;
猜想Ⅳ:除铜外,还含有氧化铜、。

【问题与讨论】
⑴步骤②包括溶解、过滤两步操作,它们共同用到的玻璃仪器是烧杯、。
⑵C的化学式为,D的化学式为,由此推出固体B中含有(填化学式),步骤④发生反应的化学方程式为。
⑶结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为,说明样品中含有,则证明猜想成立;如果溶液A无色,则证明猜想成立。
[猜想假设]
猜想(1):该溶液没有变质,为NaOH溶液
猜想(2):该溶液全部变质,为Na2CO3溶液
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液
[查阅资料]Na2CO3溶液呈碱性
[设计方案]请你完善下表几组同学探讨的设计方案
|
实验操作 |
可能出现的现象与结论 |
同学评价 |
|
|
第1组 |
|
若溶液变红,则猜想(2)不成立 |
第2组同学认为:此方案结论不正确,理由是: |
|
第2组 |
|
产生白色沉淀,则猜想(1)不成立 |
第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立 |
|
第3组 |
|
若滤液不变红,则猜想(2)成立:若滤液变红,则猜想(3)成立 |
第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是: |
[探究实验]综合各小组的方案后,动手实验.
[结论与反思]NaOH溶液易与空气中CO2反应而变质,所以要密封保存,
[拓展延伸]同学们设计了如图两套裝置进行实验:
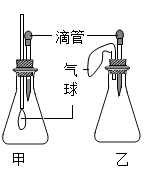
用胶头摘管吸取某种液体,锥形瓶中充入一种气体或放入一种固体物质,挤压胶头摘管,一段时间后,两装置中气球明显胀大。
⑴甲装置中可能发生反应的方程式是。
⑵若乙装置中胶头摘管吸取的是稀盐酸,则锥形瓶中放入的固体可能是。
(查阅资料)Ca(OH)2加热到一定温度时会发生分解反应,生成两种氧化物。
(实验探究)该小组称取10.0g干燥剂样品于控温电加热器中,按如图所示装置进行实验(装置气密性良好,装置A、B、C中药品足量,实验操作正确)
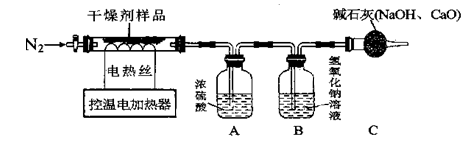
(实验数据记录)充分反应后,产物被完全吸收,A装置增重0.9g,B装置增重2.2g
(分析与结论)该包干燥剂的成分有(填化学式),其中Ca(OH)2的质量为g。
(反思与拓展)
①停止加热后,需要通入N2一段时间的目的是。
②若没有C装置,会导致含量测定结果偏小的成分是。(填物质名称)。
①将250mL瓶装碳酸饮料放在冰箱中冷冻一段时间(未结冰):
②将饮料从冰箱内取出,迅速加入质量分数为505NaOH溶液5mL;倒转饮料和轻轻振荡,然后放置恢复至室温,作待测液:
③按如图连接实验装置。取100mL待测液置于装置B的锥形瓶中,关闭开关K,打开液漏斗的活塞,向锥形瓶中注入稀硫酸,至不再产生气泡,关闭活塞;
④打开开关K,向装置中鼓入空气,一段时间后,将C装置中的物质过滤,洗涤,烘干称量质量为0.394g。

根据以上实验过程完成下列问题;
【实验目的】测定该白色固体中 NaHCO3的质量分数。
为了测定该样品中 NaHCO3的质量分数,小吕、小周分别取 a克该样品,设计了如下方案:
I.小吕方案: 利用 NaHCO3与稀硫酸反应产生 CO2 , 通过测定生成 CO2的质量,计算样品中 NaHCO3的质量分数。(2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O)

(已知: NaHCO3+ NaOH ==Na2CO3+H2O)

为使定量分析更准确,在操作 I之前,需判断所加 BaCl2溶液是否过量,请你设计一个合理方案(包括实验操作,预期现象和结论):。
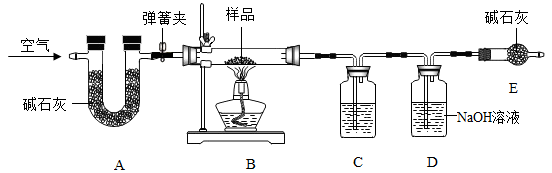
已知:①该装置气密性良好,A、C、D中所装药品足量且能完全吸收相关物质
②碱石灰是CaO与NaOH的固体混合物
③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:2NaHCO3 Na2CO3+H2O+CO2↑
探究过程如下:
Ⅰ.称量样品和已装入相关药品的装置C、D的质量,分别为:m、m1、m2;
Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热
Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷却
Ⅳ.再次称量装置C、D的质量,分别为m3、m4
请回答下列问题



①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?