| A | 高奴出脂水,颇似淳漆,燃之如麻 | 文中提到的“脂水”是指汽油 |
| B | 日照澄洲江雾开,淘金女伴满江隈 | 诗中包含了丁达尔效应 |
| C | 水银乃至阴之毒物,因火煅丹砂而出 | 这段记载中,涉及氧化还原反应 |
| D | 采蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如“石”,浣衣发面 | “石”主要是K2CO3 , 溶液显碱性 |
| 选项 | 用途 | 性质 |
| A | SiO2用作光导纤维 | SiO2能把光的强弱转变为电流的强弱 |
| B | 工业上用纯碱去油污 | Na2CO3溶液水解呈碱性,油脂碱性条件下水解程度大 |
| C | 明矾用作净水剂 | 明矾溶于水形成Al(OH)3胶体,吸附水中悬浮杂质形成沉淀 |
| D | 三元催化器处理汽车尾气 | 尾气中CO有还原性,NOx有氧化性。在催化剂作用下转化为CO2和N2 |

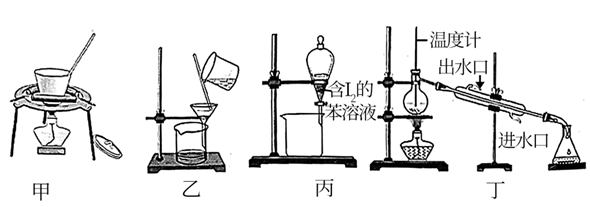
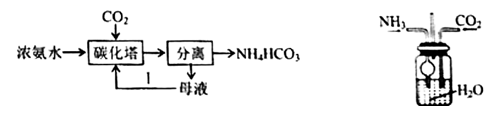
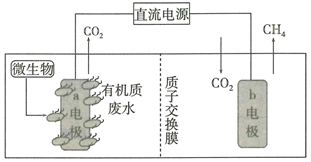

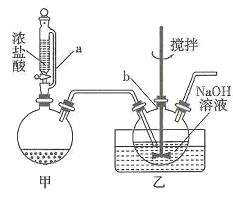
| 实验序号 | 体积/mL | |||
| K2S2O8溶液 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| 1 | 10.0 | 4.0 | 4.0 | 2.0 |
| 2 | 8.0 | 4.0 | 4.0 | 2.0 |

| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中依次摘入几滴KSCN溶液和新制氯水 | 溶液先无明显现象,后变红 | 该溶液中含Fe2+ |
| B | 将一小块金属钠放在蒸发皿里,加热 | 发出黄色火焰,生成淡黄色固体 | 金属钠在空气中加热生成过氧化钠 |
| C | 用排水法收集铜和稀硝酸加热产生的气体 | 集气瓶中充满红棕色气体 | 反应生成红棕色气体且不溶于水 |
| D | 向1mL0.1mol•L-1NaOH溶液中依次滴入2滴浓度均为0.1mol•L-1的MgCl2溶液和FeCl3溶液 | 先产生白色沉淀,后生成红褐色沉淀 | 相同温度下:Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
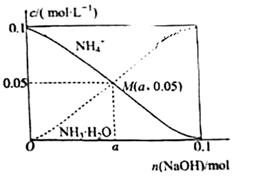
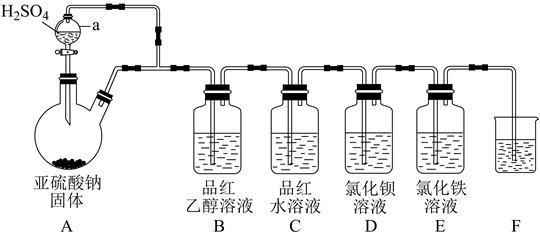

①装置中浓硫酸的作用为。
②根据表中实验现象做出合理解释。
| 组别 | 实验现象 | 合理解释 |
| 甲 | 品红溶液几乎不褪色 | 反应方程式为 |
| 乙 | 品红溶液随时间的推移变得越来越浅 | 原因可能是 |
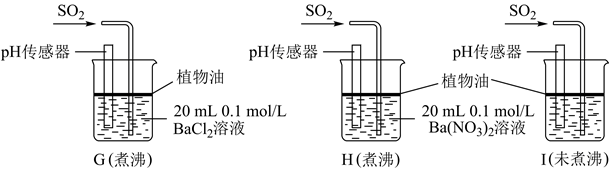 实验中G、H、I烧杯中观察到的现象如表:
实验中G、H、I烧杯中观察到的现象如表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测的溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
①据G中现象推测D中产生的白色沉淀的化学式是。
②写出H中白色沉淀产生的离子方程式。
③据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是。
 溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时的pH(c=1.0mol•L-1) | 6.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时的pH(c=1.0×10-5mol•L-1) | 8.7 | 4.7 | 3.2 | 9.0 |
i.2CO2(g)+6H2(g) ⇌C2H4(g)+4H2O(g)△H=-127.89kJ•mol-1
ii.CO2(g)+H2(g) ⇌H2O(g)+CO(g)△H=+41.2kJ•mol-1
步骤I:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)+CO(g)△H=-49.5kJ•mol-1 , 写出步骤II由甲醇制乙烯的热化学方程式。

①400~600℃,CO2的平衡转化率随着压强的升高而增大,B点v正A点v逆(填“>”“<”或“=”)。在A点给定的温度和压强下,提高CO2平衡转化率的方法有。(任写一种)
②在恒定压强下,随着温度的升高,CO2的平衡转化率先降低后升高。试分析可能原因。
③根据图像可知,为了获得更多乙烯等低碳烯烃,反应条件应控制在(填序号)。
A.压强0.1~1.0MPa B.温度300~400℃
C.压强2.0~3.0MPa D.温度900~1000℃
一定条件下,将H2和CO2[n(H2):n(CO2)=3]以一定的流速通过K—Fe—MnO/Al2O3催化剂进行反应,测得CO2的平衡转化率为50.0%,C2H4和CO的物质的量之比为2∶1,反应i的化学平衡常数Kp=(只列算式不计算)。不改变气体流速和温度,一定能提高C2H4选择性的措施有。(任写二种)

①能与NaHCO3溶液发生反应产生CO2;
②既能发生银镜反应,又能发生水解反应且水解产物酸化后可使FeCl3溶液显紫色;
③核磁共振氢谱有6组峰,且峰面积之比为6:2:2:2:1:1。
 的合成路线。
的合成路线。