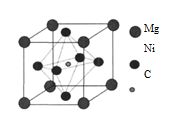
| X | Y | Z | T | |
| L |
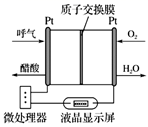
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ∙mol−1
CuCl(s)+ O2(g)=CuO(s)+
Cl2(g) ΔH2=−20 kJ∙mol−1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ∙mol−1
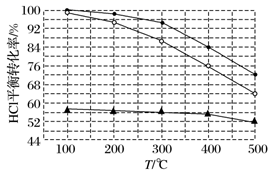
据图像分析可知:反应平衡常数K(300 ℃)K(400 ℃)(填“大于”或“小于”)。

已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
回答下列问题:
反应原理: [(CNO)3Cl2]-+ H+ +2H2O = (CNO)3H3
+ 2HClO, HClO
+ 2I- + H+ = I2 + Cl-+ H2O, I2 + 2S2O = S4O
+ 2I-
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为 V mL。
①滴定终点现象为。
②该样品的有效氯含量表达式为 。(该样品的有效氯= ×100%)
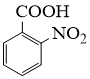 的名称是。反应②的反应类型为。
的名称是。反应②的反应类型为。
①相对分子质量比 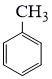 大42的苯的同系物;②与酸性KMnO4反应能生成二元羧酸;
大42的苯的同系物;②与酸性KMnO4反应能生成二元羧酸;
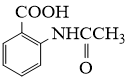
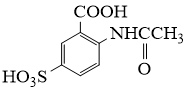
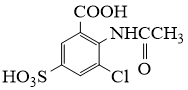
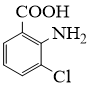
请从步骤⑥产率低的原因进行推测,上述过程能提高产率的原因可能是。若想要进一步提高产率,2−氨−3−氯苯甲酸的合成流程中,可以优化的步骤还有。