
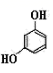
 中位于同一平面的原子数目最多为14 NA
B . 巯基(-SH)的电子式为
中位于同一平面的原子数目最多为14 NA
B . 巯基(-SH)的电子式为 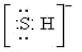 C . N2H4的结构式:
C . N2H4的结构式:  D . 常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
D . 常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
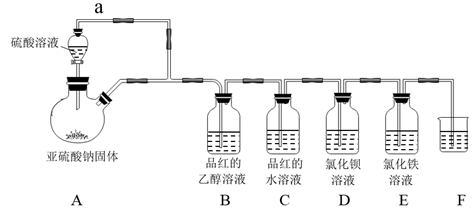


写出黄红色沉淀转化为深红色沉淀的化学方程式。
|
序号 |
盐酸浓度/mol·L-1 |
产量/g |
产率/% |
序号 |
反应温度/℃ |
产量/g |
产率/% |
|
1 |
12.0 |
3.85 |
81.3 |
1 |
75.0 |
3.02 |
63.8 |
|
2 |
6.0 |
2.99 |
63.4 |
2 |
80.0 |
3.08 |
65.0 |
|
3 |
4.0 |
2.82 |
59.7 |
3 |
85.0 |
3.33 |
70.2 |
|
4 |
2.0 |
2.25 |
47.6 |
4 |
90.0 |
3.11 |
65.6 |
|
5 |
1.0 |
2.04 |
43.0 |
5 |
95.0 |
2.91 |
61.5 |
①从平衡移动的角度分析盐酸浓度对于产率的影响。
②通过表格数据可知温度控制在左右较为适宜,原因是。
滴定终点的现象为。

回答下列问题:
a.2NH3(g)+CO2(g)⇌NH2COONH4(1) ΔH1=-119.2k.J/mol
b.NH2COONH4(l)⇌CO(NH2)2(l)+H2O(g) ΔH2
①ΔH2=。
②已知反应b的活化能远大于反应a的,则该反应机理下的决速步骤是反应(填“a”或“b”)。
③如图为某工厂的尿素合成塔内的轴向温度测定数据,根据图示数据可以推断,合成塔下部1/3的容积内都在进行反应(填“a”或“b”)。

|
温度/℃ |
NH3:CO2物质的量之比 |
|||
|
2 |
3 |
4 |
5 |
|
|
140 |
43 |
55 |
62 |
73 |
|
150 |
45 |
58 |
67 |
78 |
|
160 |
46 |
61 |
70 |
80 |
|
180 |
49 |
62 |
71 |
81 |
由表可见,氨碳比提高,尿素的平衡产率也提高,因为过剩的氨气既可以促进二氧化碳的转化,又能够,皆可使平衡向着生成尿素的方向移动。

①以下叙述能说明反应达到平衡状态的是
a.容器中氨碳比保持不变
b.气体密度保持不变
c.气体平均相对分子质量保持不变
②计算该温度下的压强平衡常数Kp=MPa-2(以分压表示,分压=总压×气体物质的量分数,结果保留三位小数)。

则该氧化物的化学式为。若rCu , =anm,ro=bnm,晶体密度为6.00g/cm3 , 计算该晶胞的空间利用率(列出计算式)。

文献报道的一条合成化合物A的路线如下:

回答下列问题: