三军将士昂首阔步
B .
三军将士昂首阔步
B .  放飞7万只气球
C .
放飞7万只气球
C .  56门礼炮齐鸣
D .
56门礼炮齐鸣
D .  飞机拉出的彩烟
飞机拉出的彩烟
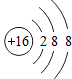 表示的粒子:S;④两个铁离子:2Fe3+;⑤导电、导热性最好的金属:Ag;⑥+2价的镁元素:Mg2+。其中,正确的是( )
表示的粒子:S;④两个铁离子:2Fe3+;⑤导电、导热性最好的金属:Ag;⑥+2价的镁元素:Mg2+。其中,正确的是( )

 B .
B .  C .
C .  D .
D . 
 点燃酒精灯
B .
点燃酒精灯
B .  稀释浓硫酸
C .
稀释浓硫酸
C .  收集O2
D .
收集O2
D .  称量7.5g食盐
称量7.5g食盐

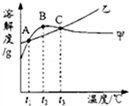
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
| Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |

海洋封存:利用庞大的水体使海洋成为封存CO2的容器,但会引起海水酸化等。
地质封存:将CO2注入特定的地层,该方法最大的风险是CO2泄漏,局部CO2浓度快速上升,直接威胁人类生命健康等。
综合利用:工业上可以将CO2转化成尿素[CO(NH2)2]、甲醇(CH3OH)等资源。科学家发现了一种镍与有机物组成的混合催化剂,利用太阳光能,将水中溶解的CO2转化成CO和O2。
依据文章内容,回答下列问题。

A.NaCl
B.NaOH
C.CaO


用高锰酸钾制取氧气
①写出反应的化学方程式:
②仪器C的名称为;

如图,用纯氮气及上述实验制取的氧气,混制一瓶氧气体积分数为40%的“富氧空气”,气体应从装置中的管(选“a”或“b”)通入,先通入氮气排出120mL水,再通入氧气排出mL水。
用下图装置测定“富氧空气”中氧气的含量(集气瓶中"富氧空气"体积为100mL,底部残留少量水,燃烧匙内有足量红磷)。操作如下:

i往量筒内加入适量水,读出量筒内水的体积为V1mL;
ii用电点火装置点燃红磷,充分反应;
iii打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为V2mL。回答问题:
实验前,检查装置气密性的方法:;
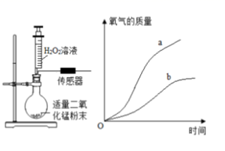
通过重油、褐煤在氧气含量不同的空气中燃烧的实验,得到有关数据如下图:

结合图1,说明空气中氧气含量与燃烧产生的温度的关系:。
|
试验编号 |
的质量分数(%) |
溶液的体积(mL) |
对应曲线 |
|
Ⅰ |
3.4 |
10.0 |
a |
|
Ⅱ |
2.4 |
10.0 |
b |
|
Ⅲ |
1.7 |
10.0 |
C(待绘制) |