
2015年是世界反法西斯和中国抗日战争胜利70周年,我国将举行盛大阅兵仪式.99式主战坦克预计会再次成为本次阅兵的一大亮点.
99式主战坦克为我国自行研制,火炮威力居于世界领先地位.炮弹初速为1940m/s,居世界第一.炮管中部的抽烟装置,由储气筒、喷嘴等组成.炮塔内炮手发射炮弹,弹丸经过喷嘴时储气筒会充入高压气体,弹丸飞离炮口后,储气筒内的高压气体便由喷嘴向外冲出,迫使炮塔中的有害气体沿炮口流出,净化了车内空气.
炮管外装有隔热套,隔热套分为内外两层,外层是为了减少环境对炮管的影响,内层是为了能使火炮发射时产生的热量快速传递,使炮管温度趋于一致,减少变形.
99式坦克还配备红外夜视仪、激光测距仪等先进设备,能够全天候作战.
抽烟装置喷嘴的开口方向,你认为图中哪一选择最符合要求

红外夜视仪夜晚能够识别人体、岩石、坦克,是因为被识别物体的 不同,发出的红外线强度不同.

(1)下列用品中,主要利用金属导电性的是 (填字母).
A.铂金饰品 B.铁锅 C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是 (填序号).①将铝、银分别浸入到硫酸铜溶液中 ②将银分别浸入到硫酸铝、硫酸铜溶液中③将铜、银分别浸入到硫酸铝溶液中 ④将铜分别浸入到硫酸铝、硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液.①滤液中一定含有的溶质是 (填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是 (填化学式).
(4)某钢铁厂每天需消耗4900t含Fe2O3 76%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁的质量是 t.
(1)物质是由微粒构成的.构成物质的微粒保持了物质的化学性质,保持水银的化学性质的最小微粒是汞原子,保持氧气的化学性质的最小微粒是 .
(2)某金属元素原子的原子核外第四层电子层上有2个电子,则该电子失去2个电子后形成的阳离子的符号是 ,若该原子的原子核中的质子数与中子数相等,则该金属元素对应的氧化物的相对分子质量是 ;若老年人体内缺少该金属元素则可能发生 .
(3)将一定质量的Al加入到Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 (填化学式);铝的化学性质较活泼,但金属铝却有良好的抗腐蚀性能,原因是;飞机外壳用的主要材料是硬铝,硬铝属于 填序号.
①有机高分子化合物; ②合金; ③复合材料.
(4)地球是我们生存的家园,保护环境就是保护我们人类自己,而老式硫酸厂污染环境十分严重,其尾气中的二氧化硫和三氧化硫会造成酸雨,其废液中的硫酸会造成水体污染,我们可用烧碱溶液处理硫酸厂的尾气,烧碱与三氧化硫反应的化学方程式为:;我们常用消石灰中和硫酸厂废液中的硫酸,请说出处理硫酸厂废液中的硫酸为什么用消石灰而不用烧碱的原因是(答一点即可).
(1)用铜制作导线是利用铜的性.
(2)小刚通过实验探究得知以下两组物质均能发生反应:
Ⅰ.铁和硫酸铜溶液Ⅱ.铝和硫酸亚铁溶液
①Ⅰ中发生反应的化学方程式是 .
②铁、铝、铜的金属活动性由强到弱的顺序是 .
③小刚继续探究某未知金属X与铁、铜的活动性强弱关系,设计了以下实验方案并对实验结果进行预测.下列实验方案及预测如果与事实相符,就可以判断出X、铁、铜金属活动性强弱顺序的有 (填序号).
A.将X放入CuSO4溶液中能反应
B.将X放入CuSO4溶液中不能反应
C.将X放入FeSO4溶液中能反应
D.将X放入FeSO4溶液中不能反应
E.将X放入FeSO4溶液中不能反应,放入CuSO4溶液中能反应.
未来金属——钛
钛被称作“未来金属”,其储量丰富,在所有元素中居第十位。钛在元素周期表中的部分信息如图。金属钛呈银白色、密度小、机械强度高、有延展性,故有较强的可塑性。而钛的导热性和导电性较差。
钛的化学性质稳定,有良好的抗腐蚀性,不受大气和海水的影响,在常温下只有氢氟酸、浓盐酸、浓硫酸等才可与它反应。钛燃烧时产生银白色分叉火星,无烟,且火焰温度极低(理论上为86~89℃),故非常安全。用它制作的烟花被称为冷烟花,被广泛用于各种庆典、舞台效果,小朋友们喜欢玩的电光花的成分中就含有钛。
钛制的坦克、潜水艇、军舰没有磁性,不会被磁性水雷发现;钛在许多场合可以代替不锈钢;镍钛合全具有“记忆”功能,变形后加热到95℃以上,便可恢复原形。


①下列不属于铁合金的是(选填字母)。
A.Fe(OH)3 B. 生铁 C. 不锈钢
②图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是(选填字母)。
在Fe2O3中,氧元素的质量分数为 。
①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数 (请根据化学方程式写出完整的计算步骤)

(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理 .
(2)铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料.以上叙述中不涉及到 (选填序号).
A.合金 B.无机非金属材料 C.合成材料 D.复合材料
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为 .
(二)铁锈成分的探究
(1)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是 (选填序号).

(2)铁生锈的主要过程为:
Fe Fe(OH)2
Fe(OH)2 Fe(OH)3
Fe(OH)3 Fe2O3•xH2O
Fe2O3•xH2O
次要过程为:Fe  FeCO3
FeCO3
写出Fe→Fe(OH)2反应的化学方程式 .
(3)铁锈组分的确定
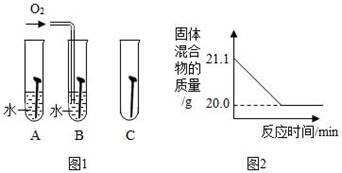
某铁锈成分为Fe2O3•xH2O和FeCO3 . 为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用如图装置进行实验.

【查阅资料】①Fe2O3•xH2O温度为110℃,FeCO3在282℃分解为FeO和CO2 . ②温度高于500℃时铁的氧化物才能被CO还原.
①装配好实验装置后,首先要 .
②装置A中的反应为: 2C2O4(草酸) CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号).
CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.则样品中FeCO3的质量m(FeCO3)=g,x= .
④若缺少G装置,测得的m(FeCO3)(选填“偏大”、“偏小”、“不变”,下同),x的值会 .
(三)炼铁过程的探究.
(1)写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式 .
【查阅资料】
用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO Fe+CO2 .
Fe+CO2 .
(2)将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼铁过程的探究.加热时测定D中剩余固体质量随温度变化的曲线如图所示.图中M点对应的a= .

如图是化学兴趣小组的同学设计和改进的实验装置,请你参与他们的探究活动.回答下列问题:

小娟同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭.请分析蜡烛熄灭的原因 , 写出纯碱与稀硫酸反应的化学方程式 ,此反应类型属于 .
认识金属元素存在:自然界中大多数金属都以化合物的形式存在.下列矿石的主要成分属于氧化物的是 (填字母序号,下同);

探究金属性质:金属原子容易失去最外层电子,化学性质活泼.图1为探究金属化学性质的实验,图2是金属化学性质网络图.

①图1甲中反应现象是 , 丙中反应的化学方程式为 ;
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是(填元素符号);
③依据图1完成金属性质网络,图2中的A属于(填物质类别);
金属在生产生活中应用广泛.
①下列金属制品的用途,利用其导电性的是;

②合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有的特性,可用于焊接电子元件;
③金属是一种有限资源,需要保护和回收利用.
黄铜(铜锌合金)用作弹壳的制造.现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示.

【收集资料】弹壳上的锈主要为Cu2(OH)2CO3 , 能与稀硫酸反应得到硫酸铜溶液;弹壳和其他杂质不溶入水,也不参加反应.
a.写出弹壳上的锈与稀硫酸反应的化学方程式 .
b.固体D为 .