 检查装置气密性
B .
检查装置气密性
B .  铁丝在氧气中燃烧
C .
铁丝在氧气中燃烧
C .  镁条和稀盐酸反应
D .
镁条和稀盐酸反应
D .  蒸发结晶
蒸发结晶
 合成材料模型
B .
合成材料模型
B .  空气组成模型
C .
空气组成模型
C .  化学反应分类
D .
化学反应分类
D . 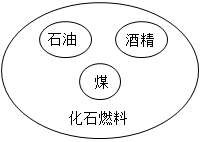 化石燃料模型
化石燃料模型
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | CaCO3粉末(CaCl2) | 除杂 | 加入足量的稀盐酸,过滤 |
| B | NH4Cl和KCl固体 | 鉴别 | 加熟石灰研磨,闻气味 |
| C | 氢气和甲烷 | 鉴别 | 点燃,在火焰上方罩一个干冷烧杯 |
| D | FeCl2溶液(CuCl2溶液) | 分离 | 加过量锌粉,充分反应后过滤 |

2021年3月20日,“考古中国”重大项目工作进展会在四川省成都市召开,通报三星堆遗址重要考古成果—新发现6座三星堆文化“祭祀坑”,新出土重要文物500多件,有高2.62米的青铜大立人、高3.95米的青铜神树、由金箔包裹的权杖、重约286克的金面具及玉石器和象牙等,多属前所未见的稀世之珍。
青铜是金属冶铸史上最早出现的合金,与纯铜相比,其强度高、熔点低、铸造性好、耐磨且耐腐蚀。《周礼•考工记》中对制作钟鼎、斧斤、戈戟等青铜器物中铜锡的比例作了详细的规定(见图)。在地下埋藏的青铜器表面会出现绿色的铜锈,其主要成分为碱式碳酸铜。

A 青铜大立人 B 金面具 C 象牙 D 玉石器
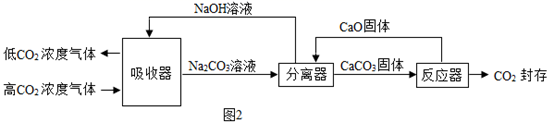
①分离器中,Na2CO3参与反应的化学方程式为。
②用该技术进行“碳捕获”有效利用了原材料,在该过程中被循环利用的物质有。
当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生;中和反应属于复分解反应。
实验用品包括烧杯、胶头滴管、玻璃棒、稀盐酸、稀氢氧化钠溶液、酚酞溶液。
|
实验步骤 |
实验现象 |
实验结论 |
|
|
一段时间后溶液由红色变为无色 |
证明稀盐酸与稀氢氧化钠溶液发生了中和反应 |
(提出问题)中和反应的实质是什么?
(查阅资料)a.一定体积的溶液中,离子的数目越多,其离子的浓度越大。电导率传感器用于测量溶液的导电性强弱,电导率值越大溶液导电能力越强。溶液的导电强弱主要与溶液中可自由移动离子的浓度和种类有关。如果离子的浓度和种类发生变化,则溶液的电导率也随之发生变化。
b.BaSO4难溶于水,即在水中难电离。
c.蒸馏水几乎不导电。
恒温条件下,向20mL一定浓度的稀Ba(OH)2溶液中滴加2滴无色酚酞溶液,插入电导率传感器,然后逐滴滴加稀硫酸,边滴加边用磁力搅拌器不断搅拌,测得溶液的电导率变化如甲图曲线所示。请写出Ba(OH)2与稀硫酸反应的化学方程式。

恒温条件下,向20mL一定浓度的稀氢氧化钠溶液中滴加2滴无色酚酞溶液,插入电导率传感器,然后逐滴滴加稀盐酸,边滴加边用磁力搅拌器不断搅拌,测得溶液的电导率变化如乙图曲线所示。通过对乙图曲线的分析,下列说法错误的是(填字母)。

A 开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B 电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C 整个实验过程中,溶液中 Na+数目一直增大


