

①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为。
①配制该营养液后c(NH )=0.016mol·L-1 , 溶液中c(K+)=。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为。

试回答下列有关问题:
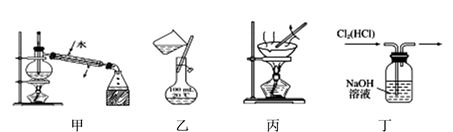
①乙装置中的试剂是;
②丁装置中稀硫酸的作用是。
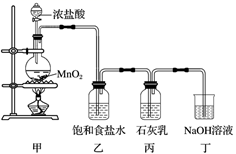
请回答下列问题:

①图中曲线I表示离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37 mol,则产物中 =。