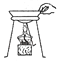
 移走蒸发皿
B .
移走蒸发皿
B . 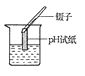 测溶液pH
C .
测溶液pH
C . 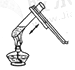 加热液体
D .
加热液体
D . 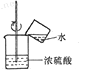 稀释浓硫酸
稀释浓硫酸
下图是甲、乙两种物质(不含结晶水)的溶解度曲线。下列说法中正确的是( )
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度/g |
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
硝酸钾 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
|
氢氧化钙 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
|
①60℃时,氯化钠的溶解度硝酸钾的溶解度(填“>”“<”或“=”)。
②氢氧化钙的饱和溶液加热后变浑浊,原因是。
③20℃时,向氢氧化钙的饱和溶液中加入少量生石灰并恢复至20℃,溶液中溶质的质量(填“增大”“减小”或“不变”)。
④要从含有少量氯化钠的硝酸钾溶液中得到较多的硝酸钾,可以采用加热浓缩、过滤的方法,得到的滤液中含有的离子有(填离子符号)。

①指出图中称量步骤的不正确操作:;。
②若用质量分数为25%的氢氧化钠溶液配制50g质量分数为10%的氢氧化钠溶液,所需25%的氢氧化钠溶液和水的质量比为。
②粗盐提纯。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤;b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是(填字母)。以上操作加入过量的Ba(OH)2溶液的作用是(用化学方程式表示)。

①实验一的目的是。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是。
②实验二的目的是。
思路分析:在实验中需要改变的因素是,需要保持不变的因素是。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会;降低温度时,其最大溶解量会。


(猜想与假设)
反应后溶液中的溶质是什么?
猜想一:只有Na2SO4;
请想二:。
猜想三:可能是Na2SO4和NaOH
以上猜想中,可以直接排除的是理由。
为了验证另外两种猜想,甲、乙、丙同学设计如下实验方案:
|
实验操作 |
实验现象 |
实验结论 |
|
|
甲同学方案 |
取少量反应后的溶液于试管中,向试管中滴加BaCl2溶液 |
有白色沉淀产生 |
猜想二成立 |
|
乙同学方案 |
取少量反应后的溶液于试管中,向试管中加入 |
有气泡产生 |
猜想二成立 |
|
丙同学方案 |
取少量反应后的溶液于试管中,向试管中加入生锈的铁钉 |
|
猜想二成立 |
老师认为甲同学方案不合理,你认为理由是。
实验结束后,废液处理方法正确的是(填序号)。
A倒入下水道 B倒入废液缸

