Zn(s)+ O2(g)= ZnO(s);ΔH=-351.5 kJ·mol-1
Hg(l)+ O2(g) =HgO(s);ΔH=-90.8 kJ·mol-1
则锌汞电池中热化学方程式:Zn(s)+HgO(s) =ZnO(s)+Hg(l)的ΔH为( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1

下列说法正确的是( )
①C的生成速率与C的分解速率相等; ②单位时间内amol A生成,同时生成3amol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的物质的量不再变化; ⑥单位时间消耗amol A,同时生成3amol B;⑦A 、B、C的分子数目比为1:3:2。
 B .
B .  C .
C .  D .
D . 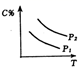

①H2(g)+ O2(g)=H2O(l);△H=﹣285kJ/mol
②H2O(g)=H2(g)+ O2(g);△H=+241.8kJ/mol
③C(s)+ O2(g)=CO(g);△H=﹣110.4kJ/mol
④C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol
回答下列各问:
②2N2H4(g)+2O2(g) 2N2(g)+4H2O(g) △H=-1068kJ/mol


在0~60 s时段,反应速率v(N2O4)为mol·L-1·s-1;反应的平衡常数K1为。


N2 (g)+ 3H2(g) 2NH3(g),10 min反应达到平衡,此时测得 N2 浓度为0.2 mol/L。
列式计算: