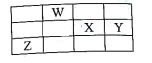
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合 | 烧杯壁变凉 | Ba(OH)2·8H2O晶体与NH4Cl的反应是吸热反应 |
| B | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变深 | NO2生成N2O4的反应中,△H>0 |
| C | 将0.1mol·L-1的氨水稀释成0.01mol·L-1 , 测量稀释前后溶液 pH | pH减小 | 稀释后NH3·H2O电离程度减小 |
| D | 常温下向物质的量浓度均为0.1mol·L-1的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| Ag2SO4 | FeS | CuS | Ag2S | |
| | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是( )


25℃时,FeCl3溶液的pH7(填“>”、“<”或“=”),原因是(用离子方程式表示)。把FeCl3溶液蒸干灼烧得到的主要产物是。
| 实验 | c(FeCl3)/mol·L−1 | V (FeCl3)/ mL | 温度/℃ | pH |
| 1 | 0.1 | 5 | 25 | x |
| 2 | 0.1 | 5 | 35 | y |
| 3 | 0.2 | 5 | 25 | z |
下列说法正确的是_______(填序号)。

往实验中加入盐酸的目的是将Na2S2O3转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
加入盐酸时发生反应的离子方程式为。

①电极X的材料是;电解质溶液Y是(填化学式)。
②银电极发生的电极反应为。

丙装置中充入滴有酚酞的氯化钠溶液,X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。
①丙装置中Y极为极(填“正”、“负”、“阴”或“阳”)。
②三种金属的活动性由强到弱的顺序是(填元素符号)。

①甲醚由(填b或c)通入。
②该电池负极的电极反应式。
③工作一段时间后,当9.2g的甲醚完全反应时,有mol电子转移。
CO(g)+H2O(g)=CO2(g)+H2(g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1 ,
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4 , 发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。

250~300℃时,乙酸的生成速率减小的原因是。
②为了提高该反应中CH4的转化率,可以采取的措施是。
 。
。
①25℃时,0.1mol·L−1HA溶液中的c(H+)=mol·L-1。
②在X点时,溶液中各离子浓度由大到小的排列顺序是。
③在K点时,溶液中c(OH-)+c(A-)-c(H+)=mol·L−1。

已知:①常温下Ag2S的Ksp为2.0×10−48
②Na2CO3与少量硼砂是为了降低灼烧温度
请回答下列问题: