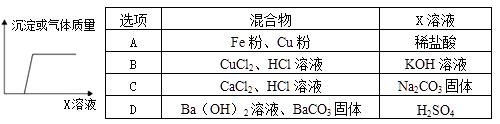
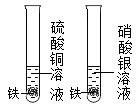
 B . 鉴别化肥KNO3和NH4Cl
B . 鉴别化肥KNO3和NH4Cl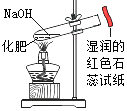 C . 干燥氨气
C . 干燥氨气 D . 粗测空气中氧气的体积分数
D . 粗测空气中氧气的体积分数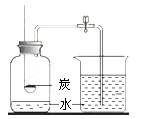
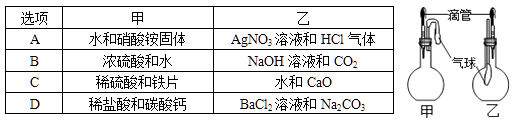
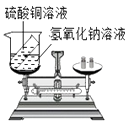 B . 检验Cl-
B . 检验Cl- 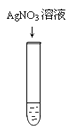 C . 配制溶液时量取水
C . 配制溶液时量取水 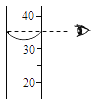 D . 干燥氧气
D . 干燥氧气 
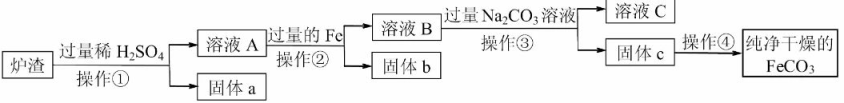
【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
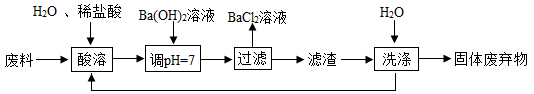
滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理,检验Ba2+的试剂可用,洗涤滤渣的主要目的是。
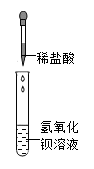
⑴在试管中加入少量粉末,注入足量的蒸馏水充分振荡溶液无色透明;
⑵取少量上述溶液滴入盐酸, 有气泡产生;
⑶另取(1)中少量溶液滴入氯化钡溶液,有白色沉淀产生
⑷在(3)中滴加稀硝酸沉淀部分溶解,并有气泡产生.
该白色粉末中一定含有;一定没有;可能含有.(均填化学名称)
步骤二:继续探究
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
|
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
▲ |
猜想②正确 |
|
白色沉淀 |
猜想③正确 |
①对方案Ⅰ的结论进行评价:。
②表格空白处的实验现象是:。
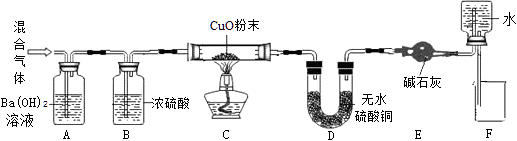
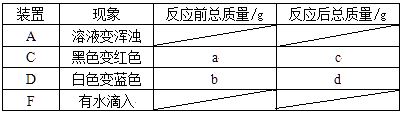
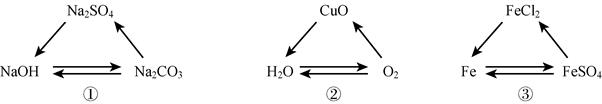
试分析回答下列问题:
【实验研究】
拉动注射器,让废气依次通过装置。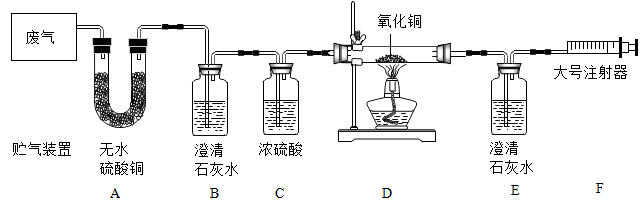
【实验分析】
【实验结果】经检验,废气中存在CO2、CO、H2O。
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体。暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想与假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象:,说明猜想正确
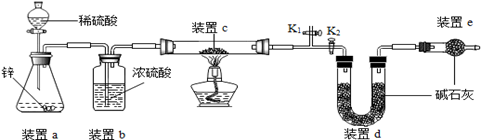
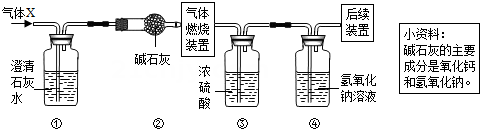
原理:Cu2O+H2 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠混合物),通过测定反应前后装置d的质量达到实验目的。
a.装置a中用稀硫酸而不用稀盐酸,原因是;
b.若不加装置e,实验结果会偏高,原因是;
c.点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2 , 关闭K1 ②检查装置的气密性 ③关闭K2 , 打开K1 , 通氢气一段时间
①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣。
②向滤渣中滴加稀盐酸,无明显的现象。
③将滤渣干燥后称量,质量为0.5g。
④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如下图所示的图像。
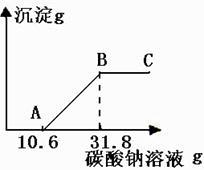
请根据小明的实验过程回答下列问题。(假设石灰石中的其余杂质不与稀盐酸反应)
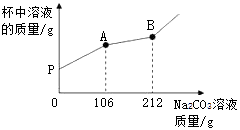
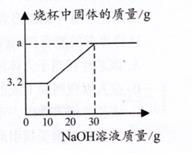
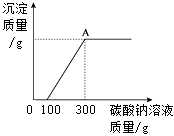
原废液中的溶质成分有(填化学式)