 B . 倾倒液体
B . 倾倒液体  C . 闻气体的气味
C . 闻气体的气味  D . 稀释浓硫酸
D . 稀释浓硫酸 
|
选项 |
酸 |
碱 |
盐 |
氧化物 |
|
A |
HNO3 |
Na2CO3 |
Cu(NO3)2 |
Fe3O4 |
|
B |
HCl |
NaOH |
NaCl |
C2H6O |
|
C |
H2SO4 |
KOH |
NH4NO3 |
H2O |
|
D |
H2O2 |
Ca(OH)2 |
ZnSO4 |
O2 |

|
实验目的 |
操作方法 |
|
|
A |
鉴别稀盐酸和稀硫酸 |
加碳酸钠, 观察产生气泡快慢 |
|
B |
除去CO2中混有的少量氯化氢气体 |
将气体通过足量的氢氧化钠溶液 |
|
C |
除去木炭中少量的CuO |
加入足量稀硫酸,过滤、洗涤、干燥 |
|
D |
除去FeSO4、CuSO4混合溶液中的 CuSO4 |
加过量锌粒、充分反应后过滤 |
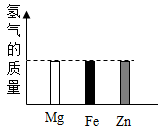 B .
B . 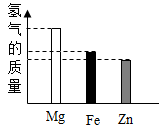 C .
C . 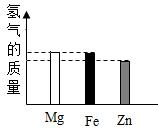 D .
D . 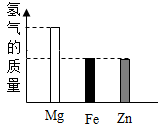
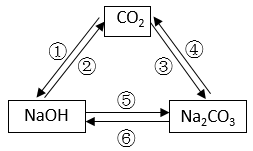

⑴试剂 X 可以是硫酸
⑵固体 Y 可以是生石灰
⑶滴加试剂 X 前锥形瓶内水的质量为 1.35g
⑷若没有球形干燥管,测得氢氧化钠固体从空气中吸收水的质量会偏小
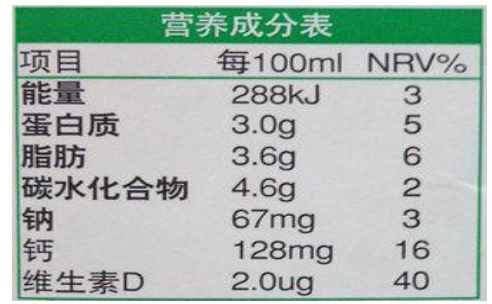
方案一:分别滴加少量食醋,有气泡产生的是。
方案二:加水溶解,分别滴加溶液,有沉淀产生的是纯碱。


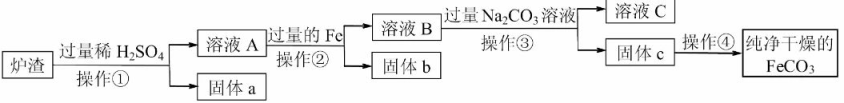
【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】

材料二:1703 年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756 年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是: “容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。

步骤二:继续探究
|
验方案 |
实验操作 |
实验现象 |
实验结论 |
|
Ⅰ |
重新取样,滴加少量AgNO3 溶液 |
白色沉淀 |
猜想②正确 |
|
Ⅱ |
重新取样, 滴加足量 Na2CO3 溶液 |
▲ |
猜想②正确 |
|
白色沉淀 |
猜想③正确 |
①对方案Ⅰ的结论进行评价:。
②表格空白处的实验现象是:。
A.紫色石蕊试液 B.铜片 C.铁锈
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显 性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据 。
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。

【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】



|
测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
|
滴加的盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
|
溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
|
溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算: