
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | | CO | |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.9 | 0.3 | a | b |

已知2mol 和
反应生成为1mol
的
,请回答下列问题.
该反应通常用 作催化剂,加
会使图中B点(填“升高”或“降低”).
①
②
③
④
回答下列问题:
上述反应中属于熵减反应的是;(写序号)
| 化学键 | | | |
| 键能 | 436 | 391 | 960 |
根据表中所列键能数据可得 .
已知水的气化热为46.0kJ/mol,表示氢气燃烧热的热化学方程式为.
反应①:
反应②:
反应③:
根据上述的热化学方程式可以判断则n2m(填“大于”、“小于”、“等于”或“无法确定”).
在密闭容器中,使2mol 和6 mol
混合发生下列反应:
(正反应为放热反应)
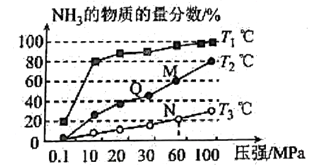

a.体积不变加入稀有气体,对正反应的反应速率影响更大
b.压强不变加入稀有气体,对逆反应的反应速率影响更大
c.如果平衡常数K值增大,对逆反应的速率影响更大
d.增加n(HCl),对正反应的反应速率影响更大

①曲线c对应的投料比是.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是.
③投料比为4:1、温度为400℃时,平衡混合气中 的物质的量分数是.(结果保留三位有效数字)