| 分类 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | NH3·H2O | 小苏打 | 氧化镁 | 一氧化碳 |
| C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
| D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| 选项 | 实验 | 现象 |
| A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
| C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
| D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
| X | Y | |
| Z | W |
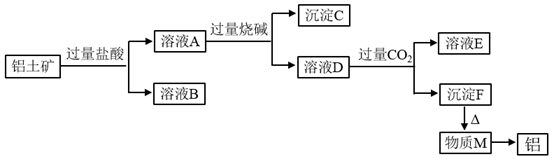
请回答下列问题: