选项 | 生产活动 | 化学原理 |
A | 葡萄酒中添加少量SO2 | SO2可杀菌且防止营养物质被氧化 |
B | 用聚乙烯塑料制作食品保鲜膜 | 聚乙烯燃烧生成CO2和H2O |
C | 利用氧化银冶炼金属Ag | 氧化银在一定条件下发生分解反应 |
D | 用地沟油为原料制作肥皂 | 地沟油发生皂化反应 |
选 项 | 常见古诗文记载 | 化学知识 |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄,硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
①Fe→FeCl2→Fe(OH)2→Fe(OH)3 ②Na→Na2O→Na2CO3→NaHCO3→NaOH
③NaAlO2→Al(OH)3→Al2O3→Al④H2S→S→SO3→H2SO4
⑤N2→NH3→NO→NO2→HNO3
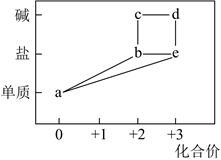
成红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
D . 硝酸亚铁溶液中滴加稀硫酸发现溶液变黄:2Fe2++| 实验 | 装置 | 试剂a | 现象 |
| ① | 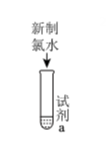 | 紫色的石蕊试液 | 溶液先变红后褪色 |
| ② | NaHCO3溶液 | 产生气泡 | |
| ③ | HNO3酸化的AgNO3溶液 | 产生白色沉淀 | |
| ④ | FeCl2溶液、KSCN溶液 | 溶液变红 |
①用氯气制备漂白粉:。
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:。
③呼吸面具中过氧化钠与二氧化碳反应:。
④KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2气体,还生成CO2和KHSO4等物质。写出该反应的化学方程式。
⑤制作印刷电路板时氯化铁溶液腐蚀铜:。
⑥用高锰酸钾酸性溶液检验溶液中的亚铁离子(还原产物为Mn2+):。
⑦在酸性条件下,向含铬废水中加入FeSO4 , 可将还原为Cr3+ , 该过程的离子
反应方程式为。

查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:i.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的
颜色有明显不同。

配制Cu(OH)2悬浊液时,要保证溶液过量。(填“NaOH”或“CuSO4”)

①根据上述实验可得结论:该红色固体为。
②产生红色固体的原因是(用离子方程式表示)。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝
色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验i的目的是。
②溶液显绿色的原因可能是溶液中含有较多Cu (HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入(填化学式),得到绿色溶液。
断,你认为不正确的是____。
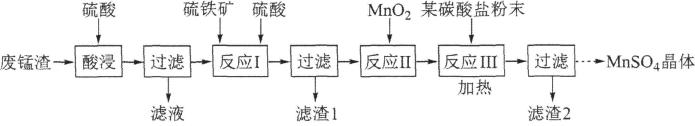
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
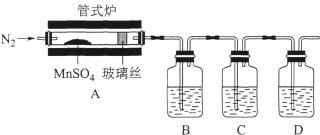
①装置B、C、D中的溶液依次为(填字母)。
a.Ba(NO3)2b.BaCl2c.品红 d.浓硫酸e.Ca(OH)2 f.NaOH
②实验结束时,为防止倒吸,正确的操作方法是。
①计算产品中MnSO4的质量分数(保留两位有效数字)。
②为提高测定的精度,应补充的实验操作。