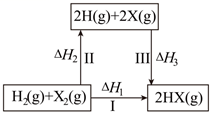
途径Ⅰ:
途径Ⅱ:在N2O中加入少量碘蒸气
① (快反应)
② (慢反应)
③ (快反应)
下列表述错误的是( )

| 选项 | 实验操作和现象 | 结论或目的 |
| A | 向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液,气泡生成速率加快 | CuSO4是该反应的催化剂 |
| B | 向5 mL0.1 mol/LKI溶液中滴入0.1 mol/LFeCl3溶液5~6滴,加2 mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I的反应有一定限度 |
| C | 将撒有Na2O2的脱脂棉放在石棉网上,然后向其中滴加少量H2O,观察现象 | 验证Na2O2与H2O反应放热 |
| D | | 验证勒夏特列原理 |




根据图乙判断,在t3时刻改变的外界条件是;①、②、③对应的平衡状态中,气体C的体积分数最大的状态是(填“①”“②”或“③”)。
a.容器中压强不变
b.混合气体密度不变
c.v正(A)=v逆(C)
d.混合气体平均相对分子质量不变

在初始体积与温度相同的条件下,甲、乙、丙中均按2mol B、1mol A投料,达平衡时,三个容器中气体B的体积分数从大到小的顺序为(用“甲、乙、丙”表示)。
|
弱酸 |
HCOOH |
H2S |
H2CO3 |
HClO |
|
电离平衡常数(25℃) |
| | | |
HCOOH的电离方程式为。
①次氯酸与NaHCO3溶液的反应:
②少量CO2通入NaClO溶液中:
③硫化氢气体通入NaClO溶液中:
④碳酸钠滴入足量甲酸溶液中:
|
温度/℃ |
c(CH3COOH)/mol/L |
电离常数 |
电离度/% |
c(H+)/mol/L |
|
0 |
16.06 |
| 9.098 | |
| 10 | 15.16 | | 10.18 | |
| 20 | 13.63 | | 11.2 | |
已知:电离度=
温度升高,CH3COOH的电离平衡向(填“左”或“右”)移动,能支持该结论的表中数据是(填字母)。
a.c(H+) b.电离度 c.电离常数 d.c(CH3COOH)

①图2电池负极区的电极反应为。
②若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现色,与铅笔接触芯接触的c位置的电极反应式为。
③若用淀粉-KI溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则导线a接的是(填“A”或“B”)电极。

①电解过程中,X极溶液的pH(填“增大”“减小”或“不变”)。
②电解过程中,Y极生成气体及Y极溶液逐渐变成紫红色发生的电极反应式分别为、。
③c(Na2FeO4)随初始c(NaOH)的变化如图4,分析c(Na2FeO4)变化趋势不同的原因:。

①
,
②
,
则
=,请写出用k1正、k1逆、k2正、k2逆表示该反应在一定温度下的平衡常数表达式K=。

①图1中CO的转化率曲线为(填“M”或“N”),图2中当X点升高到某一温度时,反应重新达到平衡,则变成相应的点为(填图2中的字母)。
②一定温度下,若起始投料比 、反应开始刚性容器总压为80kPa,研究表明:该反应的正反应速率
,当反应达到平衡状态时测得该温度下
,则p(CO) =kPa,v正=(
),该温度下
的化学平衡常数Kp=kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为研究温度对CO转化率的影响,将一定量的CO与NO置于密闭容器中,保持相同的反应时间,CO转化率与温度关系如图3所示,在 及
两个温度区间所示的CO转化率变化趋势不同,其原因是。
