 B . 配制溶液
B . 配制溶液  C . 称量固体
C . 称量固体  D . 稀释浓硫酸
D . 稀释浓硫酸 
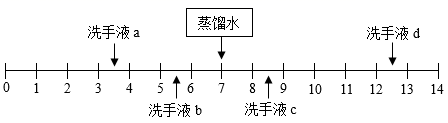
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
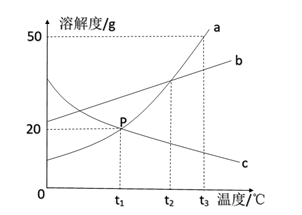
| 选项 | 实验目的 | 实验方案所用试剂 |
| A | 除去生石灰中混有的少量石灰石 | 足量的稀盐酸 |
| B | 除去二氧化碳中混有的水蒸气 | 足量的氢氧化钠固体 |
| C | 鉴别碳酸钙、氢氧化钠和硝酸铵三种固体 | 适量的水 |
| D | 鉴别盐酸和氢氧化钠溶液 | 二氧化碳气体 |


①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体




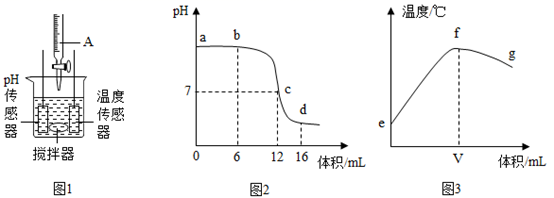

|
序号 |
实验一 |
实验二 |
实验三 |
实验四 |
|
实验内容 |
| | | |
| 实验现象 | 溶液变色 | 产生蓝色沉淀 | 无明显现象 | 无明显现象 |
| 分析与结论 | Ca(OH)2能与指示剂作用 | 反应的化学方程式为 | 无法确定是否发生反应 | 无法确定是否发生反应 |
请填写实验记录中空缺的内容①;②。
通过实验,同学们发现实验三、实验四无明显现象无法确定是否发生了化学反应。于是继续进行探究。
(探究实验)
Ⅰ、取少量实验三中的剩余溶液,滴加试液,溶液仍为无色,证明稀盐酸和Ca(OH)2溶液发生了化学反应,判断依据是溶液中完全反应了。
Ⅱ、取少量实验四中的剩余溶液,滴加足量的溶液,观察到产生气体,证明CO2和NaOH溶液发生了化学反应。请写出产生气体的反应的化学方程式。
同学们针对实验四又进行了如图所示的对比实验:

Ⅲ、将充满CO2的两支相同的试管分别倒扣入盛有不同液体(液体温度相同)的两个烧杯中,根据试管内液面上升的高度不同,确定CO2和NaOH发生了化学反应。图中横线处对右侧烧杯中液体的说明应填写;CO2和NaOH发生反应的化学方程式为。
①通过上述实验验证了碱溶液的化学性质。
②没有明显现象的化学反应,可以依据A检验反应物消失(或减少)或B.证明新物质生成这两种思路,利用间接观察法证明反应发生。上述三个实验分别是依据哪种思路设计实验方案的:Ⅰ;Ⅱ;Ⅲ(填“A”或“B”)。