 B . 证明过氧化钠与水反应放热
B . 证明过氧化钠与水反应放热 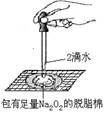 C . 制备并收集少量NO2气体
C . 制备并收集少量NO2气体  D . 实验室制备少量氨气
D . 实验室制备少量氨气 

a.呼吸面具中作供氧剂 b.漂白消毒剂 c.面粉发酵粉 d.红色油漆和涂料 e.致冷剂
A.过氧化钠;B.碳酸氢钠;C.氧化铁;D.次氯酸钠。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(粗)
(纯)
i.步骤①的化学方程式为。
ii.步骤②的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
①选用试剂: 与(填化学式)。
②用水吸收多余的氨气时,如将导管直接插入水中,会产生现象;其水溶液显弱碱性,原因是(用化学方程式表示)。
①物质M的化学式为。
②证明有红褐色胶体生成的最常用实验方法是利用胶体的重要性质,该性质是。
①需用的玻璃仪器有烧杯、量筒、胶头滴管、、。
②应该称取 固体的质量为。