
B .
B . 
C .
C . 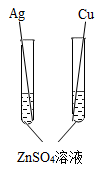
D .
D . 
①浓盐酸 ②浓硫酸 ③烧碱 ④铁粉 ⑤生石灰 ⑥食盐
 B . 称量氢氧化钠固体
B . 称量氢氧化钠固体  C . 测定溶液的 pH
C . 测定溶液的 pH  D . a 处进气收集 O2
D . a 处进气收集 O2 



①将少量氧化铁加入甲实验后的溶液中,发现红棕色固体消失,溶液变为色。
②取乙实验所得上层清液于烧杯中,为确定溶质成分,下列实验方案可行的是(填序号)
A.将烧杯久置于空气中,杯内物质质量增加(忽略水的蒸发)
B.向烧杯内通入二氧化碳,变浑浊
C.向烧杯内加入足量稀盐酸,没有气泡产生
D.向烧杯内加入氯化铵并微热,产生有氨味的气体
①X的化学式为
②铝粉在氧气中燃烧的化学方程式为
|
n(H+)与n(OH-)的相对大小 |
溶液的酸碱性 |
|
n(H+)>n(OH-) |
酸性 |
|
n(H+)=n(OH-) |
中性 |
|
n(H+)<n(OH-) |
碱性 |
据此分析

甲同学的方案:合金粉末
过滤,将得到的固体洗涤、干燥、称量,称得质量为ag。
乙同学的方案:合金粉末 过滤,将得到的固体洗涤、干燥、称量,称得质量为bg。
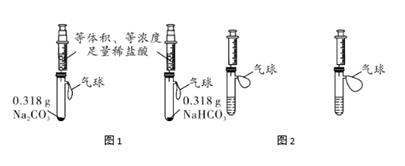
【提出问题】碳酸钠、碳酸氢钠和稀盐酸反应?
【设计与实验】甲设计的实验如图1所示实验时,将两注射器中的稀盐酸同时全部注入试管中,观察到图2所示现象。
⑴乙对甲的实验提出了质疑,他认为:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过肉眼观察很难判断;
②图2中两气球大小不一样是因为: ,所以实验中不应该取相同质量的碳酸钠和碳酸氢钠,而应取含碳元素质量相同的碳酸钠和碳酸氢钠。
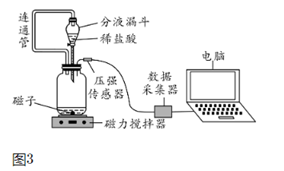

⑵小组同学在老师指导下设计了图3所示的实验。
①连通管的作用。
②广口瓶内压强随时间变化如图4所示。
【实验结论】分析图4所示的实验数据可得到实验结论。
⑶通过实验过程和数据分析,将【提出问题】补充完整。
①如图连接装置;
②向锥形瓶中加入二氧化锰粉末,加入10%的双氧水,观察现象并记录相关数据
③清洗并干燥装置,换用氧化铜粉末重复步骤②,相关数据记录表中,据此分析:

如下表:
|
物质 |
质量/g |
10%双氧水体积/mL |
集满一瓶氧气所用时间/s |
|
二氧化锰 |
0.5 |
20 |
25 |
|
氧化铜 |
________ |
20 |
38 |
④将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并(填实验操作步骤名称),证明氧化铜在反应前后质量未发生变化;
⑤向上一步所得固体中加入稀硫酸并微热,观察溶液颜色,证明氧化铜在反应前后也未发生变化。

【设计实验】小组同学经过认真分析思考,提出了自己的假设,并设计了图甲所示的实验A和B进行操究。实验时,观察到试管A中有气泡,试管B中没有气泡,从而验证了自己的假设是成立的。
【迁移应用】一次课外实验的意外现象:镁条放入Na2CO3溶液中,快速产生气泡。 请结合设置对照实验的思想,完成“气体是由什么反应生成的”问题探究。
【实验探究】查阅资料:①镁能与水缓慢反应生成氢气;②Na2CO3溶液呈碱性,其溶液中除了 Na+、 CO32-、水分子外,还有OH-。
小组同学设计了如图丙对照试验E、F和G。
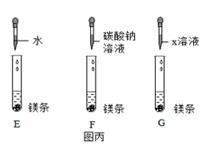
往镁条中分别加入等量的水、Na2CO3溶液、x溶液进行实验。一段时间后,观察到试管E、G中有气体产生,但缓慢且少,试管F中产生气体既快又多。从对照实验设置的角度分折,实验G所加“x溶液”应该是;
猜想三:。
【实验探究】
|
实验步骤 |
实验现象 |
实验结论 |
|
⑴用小试管取少量固体样品加水完全溶解,再滴加过量BaCl2溶液 |
产生白色沉淀 |
猜想不正确 |
|
⑵取(1)中的少量上层清液于试管中,滴加酚酞溶液 |
|
猜想二正确,猜想三不正确 |
②另一同学认为上述实验步骤可以先滴酚酞,再加过量BaCl2溶液,也可以得到正确结论。你是否同意(?
|
实验序号 |
实验方法与操作 |
实验现象 |
|
① |
将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 |
沉淀不消失 |
|
② |
|
1号试管蓝色固体不消失 |
|
2号试管蓝色固体不消失 |
||
|
3号试管蓝色固体减少 |
||
|
4号试管蓝色固体消失,溶液呈亮蓝色 |
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
|
次数 |
第1次 |
第2次 |
第3次 |
第4次 |
|
加入氯化钙溶液的质量/克 |
40 |
40 |
40 |
30 |
|
所得溶液的总质量/克 |
134 |
168 |
202 |
232 |
①取50克样品加入足量的蒸馏水,充分搅拌静置后,将浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤、洗涤、烘干后得到5克固体。
求该样品中碳酸钾的质量分数。(杂质不发生化学反应,K2CO3+CaCl2=2KCl+CaCO3↓ )