
①锌粒与稀H2SO4反应制取H2②氢气在氧气中燃烧③碳酸钙高温分解成氧化钙和二氧化碳④氢氧化钾和硫酸中和⑤Ba(OH)2•8H2O与NH4Cl反应⑥氢气还原氧化铜⑦葡萄糖在人体内氧化分解⑧制取水煤气的反应
①v(A)=0.01mol·L-1·s-1 ②v(B)=0.06mol·L-1·s-1
③v(C)=2.4mol·L-1·min-1 ④v(D)=3.5mol·L-1·min-1
| 反应 | |
| | 78.45 |
| | 2.58 |
| | 155.85 |

| | 2 | 4 | 7 | 9 |
| | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
②C(s)+ O2(g)=CO(g) ΔH2= - 110 kJ·mol-1 , 则碳的燃烧热ΔH =。


①图中曲线A表示(填“NO”“CO”“N2”或“CO2”,下同)的浓度变化,曲线C表示的是的浓度变化。
②在0~4min内NO的平均反应速率v(NO)=,4min末N2的浓度为。
③4min末,采用下列措施一定能加快上述反应速率的是(填标号)。
A.升高体系的温度 B.充入一定量的O2
C.将容器体积变为5L D.充入一定量氦气
|
实验编号 |
T(K) |
NO的初始浓度(mol•L-1) |
CO的初始浓度(mol•L-1) |
催化剂的比表面积(m2•g-1) |
|
Ⅰ |
T0 |
1.20×10-3 |
3.80×10-3 |
75 |
|
Ⅱ |
T0 |
1.20×10-3 |
3.80×10-3 |
50 |
|
Ⅲ |
T0 |
1.20×10-3 |
3.80×10-3 |
100 |
在图2中分别画出表中实验Ⅱ、Ⅲ条件下混合气体中NO的浓度随时间变化的曲线,并标明各条曲线的实验编号。

|
Ka1 |
Ka2 |
|
|
H2SO3 |
1.3×10-2 |
6.3×10-8 |
|
H2CO3 |
4.2×10-7 |
5.6×10-11 |
②SO 、HSO
、CO
、HCO
结合H+的能力由强到弱的顺序为;向Na2SO3溶液中通入CO2反应的离子方程式为。
①写出HnA与足量NaOH反应的离子方程式:。
②HnA的电离方程式为(写第一步电离)。
| | 298 | 398 | 498 |
| 平衡常数 | | | |
①试判断
(填写“>”,“=”或“<”)。
② 时,进行合成氨反应,下列能说明该反应已达到平衡状态的是(填字母序号)。
A.混合气体的平均摩尔质量保持不变B. 正
逆
C.容器内压强保持不变D.混合气体的密度保持不变
① 条件下,
的平均反应速率
。
②相对 而言,
可能改变的条件是。
③在 条件下,
时刻将容器容积压缩至原来的
,
时刻重新建立平衡状态。则图甲中在
时刻
的变化曲线可能为(填图甲中的字母序号)。

①此时 的平衡分压为
。(分压=总压×物质的量分数)
②经计算可得此时的平衡常数 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
回答下列问题:
①制取NO的离子方程式为
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为(气流方向从左至右)。
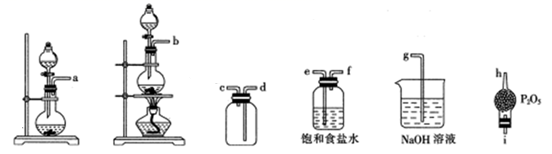
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:

①仪器X的名称为,用它代替分液漏斗的优点是
②装置C的U形管中观察到的现象是,装置D的作用是