| 选项 | 陈述I | 陈述Ⅱ |
| A | 金属钠具有强还原性 | 金属钠可制作高压钠灯 |
| B | | |
| C | | |
| D | 明矾溶于水生成 | 明矾可作净水剂 |

| 选项 | 实验操作 | 现象 | 结论 |
| A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向溶液中加入少量酸性高锰酸钾溶液 | 紫色褪去 | 可证明溶液中不含Fe3+ , 可能含有Fe2+ |
| C | Fe放入冷的浓硫酸中 | 无现象 | 铁不与浓硫酸反应 |
| D | 向硫酸亚铁溶液中加入氯水,再加入KSCN溶液 | 溶液变为红色 | 不能说明硫酸亚铁溶液中存在Fe3+ |

| A | B | C | D |
| | | | |
| 混合浓硫酸和乙醇 | 充分振荡后下层为无色 | 蒸干 | 制备 |


| 选项 | a中的物质 | b中的物质 | 实验目的、试剂和操作 | ||
| 实验目的 | c中的物质 | 进气方向 | |||
| A | 浓氨水 | 碱石灰 | 收集氨气 | 饱和NH4Cl溶液 | M→N |
| B | 浓盐酸 | MnO2 | 检验Cl2的氧化性 | Na2S溶液 | M→N |
| C | 稀硝酸 | Na2SO3 | 检验SO2的漂白性 | 品红溶液 | N→M |
| D | 稀硝酸 | Cu | 收集NO | 水 | N→M |

(提出假设)假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
|
实验操作 |
实验现象 |
结论 |
|
|
方案一 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞溶液 |
溶液变成红色 |
白色物质为Na2O |
|
方案二 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CuCl2溶液 |
出现白色沉淀 |
|
|
②静置片刻,取上层清液于试管中,滴加无色酚酞溶液 |
无明显现象 |
(思考与交流)
①通过方案1和方案2的实验,上述三个假设中,成立。钠在二氧化碳中燃烧的化学方程式为。
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:。
①84消毒液有效成分为NaClO。含氯消毒剂中HCO的消毒效果远高于ClO- , 而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7 , K2=5.6×10-11。
请回答下列问题:

根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因。
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如图:

再生塔中生成的物质(填化学式)可在流程中循环使用。
Petrusevski等人用 作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如图:

仪器中,“操作”时不需要用到的是_______(填字母)。
 B .
B .  C .
C .  D .
D . 

已知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10‑17 | 10-39 | 10-33 |

当浸取时间超过4h时,锰浸取率反而减小,其原因是。
取少量碘盐样品于试管中,加水溶解,滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液,若溶液变为色,则存在I- , 同时有无色气体产生(该气体遇空气变成红棕色)。试写出该反应的离子方程式为。
工业制备硫代硫酸钠的反应原理为 ,某化学兴趣小组用上述原理实验室制备硫代硫酸钠如图:
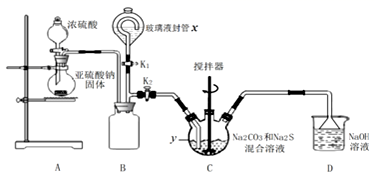
先关闭K3打开K2 , 打开分液漏斗,缓缓滴入浓硫酸,控制好反应速率。
y仪器名称,此时B装置的作用是。
A NaOH溶液 B.浓硫酸 C 饱和NaHSO3溶液
已知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.0002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为: ,
,
请根据上述数据计算该碘盐含碘量为mg·kg-1。