X | |||||
Y | Z | W |
①油脂、乙酸乙酯都属于酯类
②检验乙醇中是否含水,可用金属钠来检验
③石油的分馏,煤的气化、液化、干馏等过程均为化学变化
④蛋白质溶液中加入少量浓硝酸,微热,不发生化学反应
⑤塑料、合成橡胶和合成纤维是三大合成材料
⑥糖类、油脂、蛋白质都是只含有C、H、O三种元素的有机物
选项 | A | B | C | D |
反应装置 |
|
|
|
|
实验目的 | 测定锌与稀硫酸的反应速率 | 除去NaCl中混有的NH4Cl | 验证化学能转化为电能 | 制备乙酸乙酯 |

周期族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
A.有机物中普遍存在同分异构现象
B.有机物里的碳元素有多种同位素
C.有机物分子里碳原子间的连接方式可以是链状,也可以是环状
D.碳原子间通过共用电子对形成共价键时,可以以单键、双键或叁键结合
 的化学方程式。
的化学方程式。

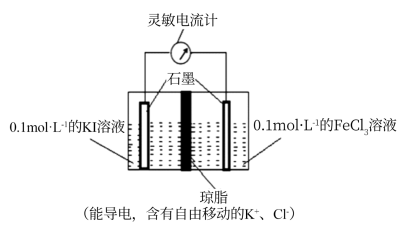
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3济液,滴入5滴稀盐酸,再继续加入2mLCCl4 , 充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是,即可证明该反应为可逆反应。你认为此方案(“不严密”或“严密”),理由是(用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是。