| 选项 | 归类 | 物质(或变化) |
| A | 人体中常见微量元素 | 碘、硒、镁、铁等 |
| B | 大气污染物 | 粉尘、二氧化硫、二氧化碳 |
| C | 常见合金 | 不锈钢、生铁、黄铜 |
| D | 氧化反应 | 钢铁生锈、光合作用、食物腐烂 |


| 序号 | 物质 | 实验目的 | 所用试剂或方法 |
| A | N2(O2) | 除杂 | 通过灼热的木炭粉 |
| B | CO、CH4 | 鉴别 | 点燃,火焰上方罩干冷烧杯,观察现象 |
| C | Cu(Fe) | 检验 | 加入稀盐酸,观察有无气泡产生 |
| D | CaCO3和CaCl2的混合物 | 分离 | 溶解、过滤、洗涤、干燥、蒸发 |

A、氢气 B、活性炭 C、一氧化碳 D、二氧化碳 E、石灰石 F、生石灰 G、二氧化硫 H、武德合金


请回答以下问题:
a.沸点 b.密度 c.溶解性



a.Zn b.Cu c.Fe

A.石灰石、浓盐酸 B.石灰石、稀硫酸 C.石灰石、稀盐酸
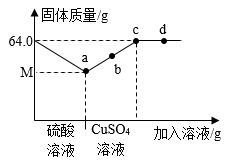
若用E装置收集CO2 , 气体应从(选填“a”或“b”)端通入。

①若H中(填现象,下同)。I中,说明M中含CaCO3。
②用F制气体相对于B的优点有。
(一)气体成分的探究
(资料1)①无水硫酸铜遇水变蓝;
②氢氧化钠溶液可以充分吸收CO2。

(现象)实验中观察到A中,说明有水生成, B中澄清石灰水变浑浊,说明生成了, B中发生反应的化学方程式为。
(计算) a:b:c=。
(资料2)1、Cu和Cu2O均为红色固体;2、Cu2O+ H2SO4=CuSO4+Cu+H2O。
(猜想)红色固体可能是:猜想1:Cu 猜想2:Cu2O 猜想3:
②反应后测得红色固体质量为2.16g
没有镁的存在,就不能形成叶绿素,也就没有光合作用,这里的镁是指______。
(查阅资料)①氢氧化钙溶液能吸收二氧化碳;
②一氧化碳还原氧化铁是逐步失去氧元素的过程。
|
铁及铁的氧化物 |
Fe |
FeO |
Fe2O3 |
Fe3O4 |
|
颜色 |
黑色 |
黑色 |
红棕色 |
黑色 |
|
能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |

(实验探究)兴趣小组设计了如上图实验装置进行实验。将24.0g氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。
兴趣小组猜想黑色粉末可能是:(1)铁粉;(2)四氧化三铁;(3)你的猜想是。
|
反应前 |
反应一段时间后 |
|
|
Ⅰ组 |
玻璃管和红色粉末的总质量为44.0 g |
玻璃管和固体物质的总质量为43.2g |
|
Ⅱ组 |
试管和所盛溶液的总质量为30.0 g |
洗气瓶和瓶中物质的总质量为32.1g |
(交流讨论)
实验前应该先。
最终计算结果表明:黑色粉末是,请写出该变化的化学方程式。
(查阅资料)①Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
②MgCO3:白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
③MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
工业生产中得到的碱式碳酸镁晶体是xMgCO3•yMg(OH)2•zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,最后完全反应),测定剩余固体质量与分解温度之间关系。
(数据处理)剩余固体质量与加热时间关系如图所示:

请回答下列问题:
0~t1固体质量没有发生变化的原因可能是。