 B .
B .  C .
C .  D .
D . 
 B . 奔跑的豹有动能
B . 奔跑的豹有动能  C . 食物中有化学能
C . 食物中有化学能  D . 跳水运动员有弹性势能
D . 跳水运动员有弹性势能 


|
选项 |
甲 |
乙 |
|
A |
Fe2O3 |
稀硫酸 |
|
B |
CO2 |
NaOH溶液 |
|
C |
稀盐酸 |
Ca(OH)2溶液 |
|
D |
稀盐酸. |
AgNO3溶液 |
 B .
B .  C .
C .  D .
D . 
|
选项 |
物质(括号内为杂质) |
除去杂质所用试剂和方法 |
|
A |
KNO3 (NaCl) |
加入足量水溶解,过滤 |
|
B |
CaCl2(HCl) |
加过量的CaCO3粉末,过滤 |
|
C |
CaO(CaCO3 ) |
加水、过滤,蒸发 |
|
D |
CuSO4粉末(FeSO4) |
加入足量铜粉,过滤 |

 B . 金属细丝
B . 金属细丝  C . 铜制电缆
C . 铜制电缆  D . 铁锤
D . 铁锤 



小组同学依据生活经验做出猜想,下列交通安全标语中能做为本实验猜想依据的是 。
|
编号 |
实验操作 |
实验现象 |
|
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
|
乙 |
将表面打磨后的铝丝浸入CuSO4液中 |
铝丝表面析出红色固体 |
|
丙 |
将表面未打磨的铝丝浸入CuCl2液中 |
铝丝表面析出红色固体 |
[提出问题]如何判断酸.碱溶液发生了化学反应?
[实验药品]一定质量分数的稀盐酸,一定质量分数的氢氧化钠溶液(稀)、酚酞溶液、蒸馏水。
[实验探究]
实验一.50mL稀盐酸与50mL氢氧化钠溶液混合(曲线a);
实验二.50mL稀盐酸与50mL蒸馏水混合曲线b);
实验三.50mL氢氧化钠溶液与50mL蒸馏水混合(曲线c)。

结合实验目的分析,增加实验二、实验三的目的是。
对比三条曲线,可以得到如下结论:
①氢氧化钠溶液和稀盐酸一定发生了化学反应。
②酸和碱之间的反应是反应(填“放热"或“吸热”)。
甲小组认为,通过实验探究(2)得出“酸和碱之间的反应是放热反应”的结论不严谨,应该补充实验。

[提出问题]二氧化碳与氢氧化钠能否发生反应?
[查阅资料]①已知碳酸氨钠溶液不与二氧化碳反应。
②饱和碳酸氢钠溶液可除去二氧化碳气体中的氯化氢气体。
③常温下,氢氧化钠易溶于乙醇,碳酸钠难溶于乙醇。
[方案设计]小明同学设计了如图所示装置进行探究。
[实验探究]
⑴C瓶中饱和NaOH的乙醇溶液配制.将一定质量的氢氧化钠固体加入到一定体积的乙醇中,充分搅拌,使其成为饱和氢氧化钠的乙醇溶液。
⑵进行实验.①按图所示装置加入药品后进行实验。
②B装置的作用是,C中可观察到的实验现象是。
[实验结论]
⑶C中发生反应的化学方程式为,可以证明二氧化碳与氢氧化钠能发生化学反应。
[提出猜想]气体可能是HCl、NH3、H2中的一种或几种。
[查阅资料]①NH3+HCl=NH4Cl
②2NH3+H2SO4=(NH4)2SO4
③NH3能使酚酞试液变红
④3CuO+2NH3=3Cu+N2+3H2O
[实验探究]为了探究气体的成分,小明设计了如图装置开展相关实验。请回答

![]()
①开球成功,所选足球(物质)能与首杆(甲)发生反应.则表示该同学开球成功。
②连续过杆,前一次反应的生成物能与下一杆发生反应时,则通过该杆。
③满分情况,所选足球能与首杆反应且能连续通过乙丙丁戊四杆为满分。
④每支杆代表一种物质,可选的杆为:O2、CO、NaOH、BaCl、H2SO4。




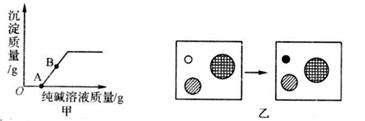
|
实验一 |
实验二 |
实验三 |
实验四 |
|
|
食用碱的质量 |
12g |
12g |
12g |
12g |
|
加入CaCl2溶液的质量 |
20g |
40g |
60g |
80g |
|
生成沉淀的质量 |
4g |
m |
10g |
10g |