


实验操作 | 实验现象 | 实验结论 | |
A | 向AgCl悬浊液中加入少量KI固体 | 沉淀由白色转化为黄色 | |
B | 向 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
C | 测定饱和 | 后者pH更大 |
|
D | 向滴有酚酞的 | 生成白色沉淀,且红色逐渐变浅 |
|

 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为(填元素符号)。基态N原子核外电子的运动状态有种,1 mol
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为(填元素符号)。基态N原子核外电子的运动状态有种,1 mol 中含有
中含有选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于。
①滴定达到终点时的现象是滴入半滴标准NaOH溶液后。
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为mL。

③已知实验所用标准NaOH溶液的浓度为 , 根据上述滴定结果可知该白醋(填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是(填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失

①滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。
②和
的关系:
(填“>”“=”或“<”)。
③若25℃时,的醋酸与
的氢氧化钠溶液等体积混合量中性,则醋酸的电离常数为(用含a的代数式表示)。
的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
。步骤如下:
①称取1.250 g胆矾产品配成100 mL溶液;
②取其中25.00 mL溶液,滴加KI溶液至不再产生沉淀;
③用标准溶液滴定,平行滴定3次。
若标准溶液的平均用量为10.00 mL,则胆矾产品纯度为%。

①氢气的物质的量在温度高于800后增大的可能原因是、。
②“直接二甲醚()燃料电池”被称为绿色电源,其工作原理如图2所示,正极为电极(填“A”或“B”),写出A电极的电极反应式:。

①表示转化率的曲线是(填“a”或“b”);
②M点对应的百分比为%(保留三位有效数字)。
已知,① , 反应体系中每摩尔气态物质分解为气态基态原子消耗的能量如下表所示:
CO | NO | ||
812 kJ | 1076 kJ | 1490 kJ | 632 kJ |
②
③
①保持恒温,下列能说明反应达到平衡状态的是(填标号)。
a.体系压强保持不变 b.混合气体密度保持不变
c.和NO的体积比保持不变 d.每消耗
的同时生成
②℃、
℃时,物质的分压变化如图所示。根据题意可知:
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是。

①反应开始到平衡时CO的平均反应速率;
(用含p的代数式表示,已知:某气体的分压=总压×该气体的物质的量分数)
②若此温度下,某时刻测得、
、
、
的浓度分别为
、
、
、
, 要使反应向逆反应方向进行,a的取值范围是。

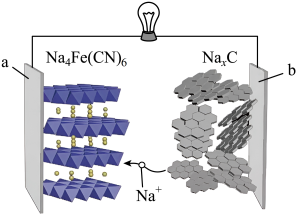
回答下列问题:
图中装置的能量转化形式为,a、b均为石墨电极,b极的电极反应式为。

已知:
a.常温下,难溶物、
的
均大于
的
,
可溶;
b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。

回答下列问题:
下列说法不正确的是(填序号)。
a.溶液的
b.的
为
c.溶液中,