 B . HClO的结构式:H-O-Cl
C . 基态碳原子的轨道表示式:
B . HClO的结构式:H-O-Cl
C . 基态碳原子的轨道表示式:

选项 | A | B | C | D |
实验及现象 |
热水中烧瓶内气体颜色变深 |
试管中出现白色沉淀 |
①中产生白色沉淀②中产生红褐色沉淀 |
Cu上无气泡,Fe上有气泡 |
结论 | 2NO2(g) | 酸性:H2CO3>H2SiO3 | 溶解度:Mg(OH)2>Fe(OH)3 | 还原性:Fe>Cu |
X | |||
W | Y | R | |
Z |

选项 | 反应温度/℃ |
| 稀 | |||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | x |
③ | 25 | 10 | 0.1 | 5 | 0.2 | 5 |
④ | 50 | 10 | 0.1 | 10 | 0.1 | 0 |


下列说法错误的是( )
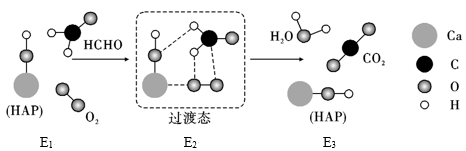
已知:HCHO(g)+O2(g)=CO2(g)+H2O(g)ΔH=-526.7kJ·mol-1
下列说法正确的是( )


元素 | Mn | Fe | |
电离能/(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
根据表中数据可知,气态再失去1个电子比气态
再失去1个电子难,对此,你的解释是。
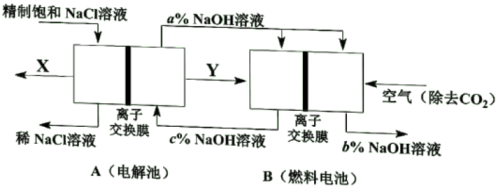
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
步骤Ⅰ:取一定量的废锂电池,加入适量的稀硫酸和30%的溶液,待固体充分溶解,过滤。
步骤Ⅱ:向滤液中滴加NaOH溶液,调节pH进行除杂,过滤。
步骤Ⅲ:向步骤Ⅱ的滤液中加入溶液,水浴加热至50℃左右,反应生成
沉淀。
步骤Ⅳ:在纯氧中加热分解得到
。
回答下列问题:

该反应一般认为通过如下步骤来实现:
①
②
=kJ/mol。

A.恒温恒压,t2时刻通入惰性气体
B.恒温恒容,t2时刻通入一定量氢气
C.n点的v(正)一定大于m点的v(逆)
D.t2时刻,可能是移走了一部分水蒸气
Ⅱ.二氧化碳也可用于尿素的制备:

已知:ClO+4I−+4H+=2H2O+2I2+Cl− , I2+2S2O
=2I−+S4O
①滴定终点的现象是:。
②下列关于滴定分析的操作,不正确的是。
A.用量筒量取25.00mL水样
B.滴定时要适当控制滴定速度
C.装标准溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,造成测定结果偏低
D.终点读数时俯视滴定管液面,会造成测定结果偏低
E.再次滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
③计算水样中ClO的浓度
