A | B | C | D |
|
|
|
|
中和热的测定 | 钢闸门(被保护)与外接电源的正极相连以实现外加电流法 | 铁钥匙上镀铜 | 验证不同催化剂对化学反应速率的影响 |
①明矾、氯化铁晶体常用于净水
②比较NH4Cl和Na2S等某些盐溶液的酸碱性
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂
④实验室通常使用热的纯碱溶液去除油污
…… | ① | ② | ③ | |
…… | ④ | ⑤ |
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0 kJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ/mol
下列说法正确的是( )
序号 | 实验操作 | 实验目的 |
A | 向含有AgCl和AgNO3的浊液中滴加Na2S溶液,有黑色沉淀生成 | 证明Ksp(Ag2S)sp(AgCl) |
B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
C | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |


A.1.5mL B.20mL C.大于20mL D.小于20mL
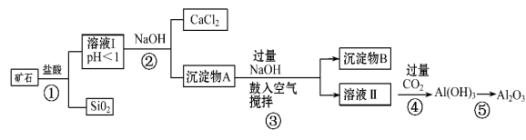
①由NaOH固体配制0.10mol/LNaOH标准溶液,需要的仪器有药匙、玻璃棒、(从图中选择,写出名称)。

②取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
滴定达到终点的标志是。根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
③用NaOH标准溶液滴定未知浓度的盐酸时,下列各操作中无误差的是(填序号)。
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后,再用待测盐酸润洗,而后装入一定体积的盐酸溶液进行滴定
C.用酸式滴定管量取10.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴酚酞后进行滴定
D.滴定完毕读数后发现滴定管尖嘴还残余1滴液体
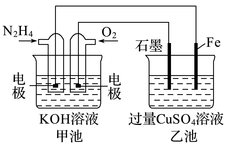
①甲池中N2H4发生的是(填“氧化反应”或“还原反应”),乙池中SO向移动(填“左”或“右”)。
②乙池中总反应的离子方程式为。
③要使乙池恢复到反应前的状态,应向溶液中加入(填化学式)。
N2(g)+O2(g)=2NO(g) ∆H=-bkJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) ∆H=-ckJ/mol
则2NO(g)+C(s)=CO2(g)+N2(g) ∆H=kJ/mol。
已知2NO(g)+2CO(g)N2(g)+2CO2(g) ∆H<0。
①该反应能自发进行的条件是。
②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是。
A.v(CO)正=2v(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
③向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1T2(填“>”、“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为K=,平衡时混合气体中CO的体积分数为。

|
化学式 |
电离常数(25 ℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为。