 C . 醋酸的电离方程式:CH3COOH+H2O
C . 醋酸的电离方程式:CH3COOH+H2O


操作 | 现象 | 结论或解释 | |
A | 向FeCl3溶液中滴加过量的KI溶液,一段时间后滴入KSCN溶液 | 溶液变为红色 | KI与FeCl3不反应 |
B | 常温下测同浓度NaA溶液和Na2CO3溶液的pH | NaA溶液的pH小 | 酸性:HA>H2CO3 |
C | 向NaHCO3溶液中滴加饱和CaCl2溶液 | 产生白色沉淀,同时有气泡冒出 | 沉淀是CaCO3 , 气体是CO2 |
D | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 沉淀颜色变深 | Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |




通入CO2气体的一极为(填“阴极”、“阳极”、“正极”或“负极”),写出该极的电极反应式:。


已知①当溶液中某离子浓度小于10-5 mol/L时认为沉淀完全;
②NH3·H2O的电离平衡常数Kb=1.8×10-5;H2C2O4的电离平衡常数Ka1=5.9×10-2、Ka2=6.5×10-5。
溶液中金属离子浓度用c(An+)表示,-lgc(An+)随溶液pH变化的图像如图所示:

回答下列问题:

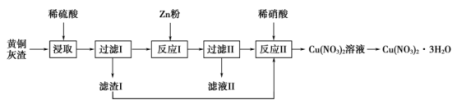
则“酸浸”的适宜温度和时间分别为(填字母)。
a.30℃、30 min b.90℃、150 min c.70℃、120 min

实验I:探究中和滴定原理
i.连接计算机、pH传感器等仪器并组装,如图1所示。
ii.向烧杯中加入20.00mL0.1000mol·L-1盐酸,放入磁子,置于搅拌器上。
iii.向50mL碱式滴定管中加入0.1000mol·L-1NaOH溶液,赶走气泡,并调零。
……
v.向小烧杯中逐滴加入NaOH溶液,得到图2中的pH变化曲线图。
实验II:测定废水水样的COD(即化学需氧量,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要氧的毫克数,以mg/L表示。)
i取某湖水水样100.00mL,酸化后加入0.1000mol·L-1的K2Cr2O7溶液20.00mL,使水中的还原性物质完全被氧化(Cr2O被还原为Cr3+);
ii再用1.000mol·L-1的FeSO4溶液滴定剩余的Cr2O , 3次平行实验中消耗FeSO4溶液情况如下表。
|
序号 |
起始读数/mL |
终点读数/mL |
|
1 |
0.00 |
10.10 |
|
2 |
1.20 |
11.10 |
|
3 |
1.50 |
14.60 |
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
②CO2(g)+H2(g)CO(g)+H2O(g) △H2
③CO(g)+2H2(g)CH3OH(g) △H3=-90kJ·mol-1
回答下列问题:

①图中X代表(填化学式)。
②由图可知温度为T时,反应②的平衡常数K1(填“>”“<”或“=”)。
①平衡后,反应①的平衡常数Kp为kPa-2(用平衡分压代替平衡浓度来表示)。
②实验表明:在二氧化碳和氢气的混合气体中掺混一氧化碳有助于提高甲醇产率。甲醇的平衡产率随着CO/(CO+CO2)变化如图所示:

从平衡移动角度分析,甲醇平衡产率上升的原因;当CO/(CO+CO2)为0.4时,改为在体积可变的容器中进行此反应,则甲醇的平衡产率最有可能是(填“a”、“b”、“c”或“d”)。