
①每个原子都达到8电子稳定结构,且为非极性分子
②键角有180°、120°、90°三种
③受热后会分解生成
,
分子呈三角锥形
④分子中5个键完全相同

已知: ,
,
请写出与
反应的热化学方程式。
Ne | |||
汽化热 | 548 | 1369 | 105 |
汽化热特别大的原因是。
元素 | 电离能 | |||||
… | ||||||
R | 740 | 1500 | 7700 | 10500 | 13630 | … |
关于元素R的下列推断中,正确的是(用相应的编号填写)
①R元素基态原子的电子排布式为
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为价
④R元素的第一电离能高于同周期相邻元素的第一电离能
已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为
, 忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=J。
①该反应的平衡常数表达式为
②判断该反应的自发性
③在恒温恒容下,同时放入、
、
、
四种物质,下列事实能够说明反应
已达到平衡的是。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有键断裂的同时有
键断裂
D.混合气体的平均相对分子质量保持不变

①请在图中画出压强为时
的平衡转化率随温度的变化曲线。
②现有实验测得反应在750℃下,以不同碳氧比[
]投料时反应达平衡后
的转化率及
、CO的选择性,所测数据如表所示。
已知:选择性=目标产物的产率/反应原料的转化率
碳氧比[ | 1∶0.25 | 1∶0.5 | 1∶1 | 1∶1.25 |
| 0.40 | 0.88 | 0.98 | 0.99 |
| 0.98 | 0.93 | 0.67 | 0.40 |
CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
最佳碳氧比[]为。
假设按碳氧比投料,反应容器的体积为VL,通入
和
各amol,请列式表示平衡时容器内CO的浓度(用a、V的代数式表示)
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于时,可认为已完全沉淀。
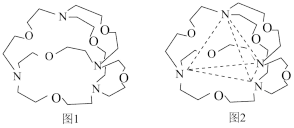
下列分子或离子中,能被该有机化合物识别的是____(填标号)。