

a.氮气 b.氧气 c.氢气
a.N2O b.NO c.N2O3
a.酸 b.碱 c.盐
a.C b.D c.E
![]()


①该转化中循环利用的物质有Fe3O4和(填化学式);
②与电解水相比,该方法的优点是。
①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是;
②如图乙所示,投入纳米CaO时,H2的百分含量最大的原因是。
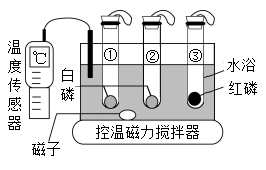
①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强(填“大于”或“小于”)外界大气压;
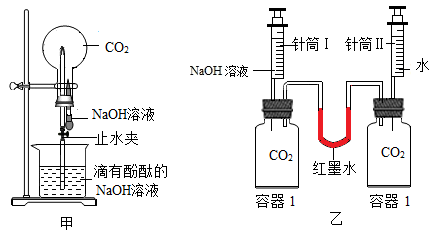
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是;
③写出CO2与NaOH溶液反应的化学方程式:。
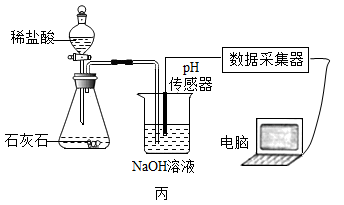
①写出图丙中制取CO2的化学方程式:,检验CO2的方法是;
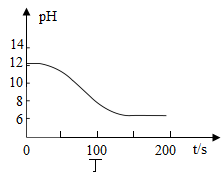
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是(填离子符号)。
①检验烧碱样品中是否含有Na2CO3 , 可选择的试剂是(填字母);
a.稀盐酸b.澄清石灰水c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
某研究小组为探究CO的还原性,设计了如下系列实验。
实验1:将CuO加水制成糊状,刷在试管内壁,在试管底部加入炭粉,再向试管中通入CO2(见图甲),集满后立即用气球密封。
实验2:用酒精灯加热CuO部位(见图乙),无明显现象。
实验3:用加网罩的酒精灯加热炭粉(见图丙);一段时间后,利用CO2传感器测得试管内CO2含量变小。
实验4:加热CuO(见图丁),黑色固体变成紫红色。

①实验1中浓硫酸的作用是;
②实验2得到的结论是;
③实验3的目的是,酒精灯加网罩的作用是;
④写出实验4中发生反应的化学方程式:。
方法1:火法炼铜.Cu2S在高温下与氧气反应的部分转化关系如图:
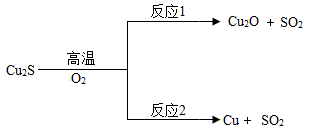
①Cu2O中铜元素的化合价为;
②反应2的基本类型是;
方法2:生物炼铜。Cu2S在酸性环境和微生物菌类的作用下转化为CuSO4的原理是Cu2S+O2+2H2SO4═2CuSO4+2H2O+X。
③X的化学式为;
④从含有CuSO4和H2SO4的混合溶液中回收铜,请补充完整实验方案。
步骤1:向一定量的混合溶液中加入过量的试剂Y,过滤,得到滤渣和滤液1。
步骤2:取步骤1中的滤渣,,过滤,得到Cu和滤液2。
步骤3:将滤液1与滤液2合并,冷却结晶,得到FeSO4•7H2O晶体。
写出步骤1中发生反应的化学方程式:(任写1个)。