
选项 | 生活应用或生产活动 | 化学知识 |
A | 用SO2漂白纸张 | SO2具有氧化性 |
B | 用铝槽车运输浓硝酸 | Al在冷的浓硝酸中发生钝化 |
C | 用生石灰作食品干燥剂 | CaO易与水反应 |
D | 用Si制作芯片 | Si是良好的半导体材料 |





选项 | 实验操作或实验方案 | 目的 |
A | 向KMnO4固体中加入浓盐酸,产生的气体依次通过饱和食盐水和浓硫酸 | 制取并纯化氯气 |
B | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 检验Na2SO3固体是否变质 |
C | 用Na2S2O3溶液分别与0.05mol·L-1、0.1mol·L-1的H2SO4反应,记录出现浑浊的时间 | 探究浓度对反应速率的影响 |
D | 向AgNO3与AgCl的混合浊液中加入少量KBr溶液,沉淀颜色变为浅黄色 | 证明Ksp(AgCl)>Ksp(AgBr) |


海带→灼烧→过滤→氧化→萃取、分液→I2的CCl4溶液
上述实验流程中不需要用到的仪器是(从下列图中选择,写出名称)。

查阅资料:该反应速率与c(S2O82-)和c(I-)的关系v=kcm()cn(I-),k为常数。
实验任务:测定不同浓度下的反应速率确定所m、n的值。
实验方法:按下表体积用量V将各溶液混合,(NH4)2S2O8溶液最后加入,记录开始反应至溶液出现蓝色所用的时间t。实验过程中发生如下反应:+2I-=2
+I2(慢)I2+2
=2I-+
(快)
实验记录表:
实验编号 | A | B | C | D | E |
0.2mol·L-1(NH4)2S2O8溶液/mL | 10 | 5 | 2.5 | 10 | 10 |
0.2mol·L-1KI溶液/mL | 10 | 10 | 10 | 5 | 2.5 |
0.05mol·L-1Na2S2O3溶液/mL | 3 | 3 | 3 | 3 | 3 |
0.2mol·L-1KNO3溶液/mL | 0 | V1 | V2 | V3 | V4 |
0.2mol·L-1(NH4)2SO4溶液/mL | 0 | V5 | V6 | V7 | V8 |
0.2%淀粉溶液/mL | 1 | 1 | 1 | 1 | 1 |
t/s | t1 | t2 | t3 | t4 | t5 |
加入KNO3、(NH4)2SO4溶液的目的是控制实验条件,其中V1,V4,V5。
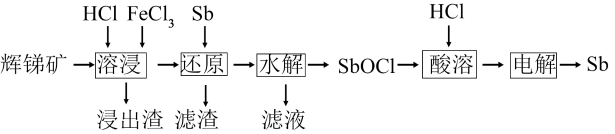
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时(c=0.01mol·L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
回答下列问题:
①Sb3+发生水解的离子方程式为。
②下列能促进该水解反应的措施有(填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3 , Fe3+浓度应小于mol·L-1。
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ·mol-1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41kJ·mol-1
III.CO(g)+2H2(g)⇌CH3OH(g) ΔH3
回答下列问题:

计算反应III的ΔH3=kJ·mol-1 , 其对应的曲线为(填“a”或“c”)

①图中代表CH3OH的曲线为(填“m”或“n”)。
②解释150~250℃范围内CO2转化率随温度升高而降低的原因。
③下列说法不正确的是(填字母)。
A.H2的平衡转化率始终低于CO2的
B.温度越低,越有利于工业生产CH3OH
C.加入选择性高的催化剂,可提高CH3OH的平衡转化率
D.150-400℃范围内,温度升高,H2O的平衡产量先减小后增大
④270℃时CO的分压为,反应II的平衡常数为(列出算式)。
 B .
B .  C .
C .  D .
D . 

①晶体中与Al距离最近的Al的个数为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
,
),原子2的坐标为(
,
,
),则原子3的坐标为。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA , 则晶体的密度为g·cm-3(列出计算式)。
条件:a.能够发生银镜反应;b.可与FeCl3溶液发生显色反应。
写出其中核磁共振氢谱在苯环上有两组峰,且峰面积为1:1的同分异构体的结构简式。
 的路线(其他试剂任选)。
的路线(其他试剂任选)。