①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
原子 | N | S | O | Si |
半径/nm | 0.075 | 0.102 | 0.074 | 0.117 |


已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
②(无色,溶液
)
锰有多种化合价,如+7、+6、+4、+2价等,在中性溶液里高锰酸钾的还原产物一般为(填化学式)。
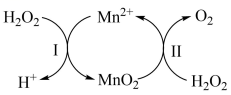
①已知反应Ⅱ为:
, 写出反应Ⅰ的热化学方程式(焓变用
和
表示):。
②某温度时,向10mL0.4mol/LH2O2液中滴入1滴发生上述分解反应,测得不同时刻生成
的体积(已折算为标准状况下体积)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
时反应速率比
时的慢,其原因是:。
的平均反应速率v(H2O2)= (忽略溶液体积变化)。