
 互为同分异构体
D . 1 mol该物质与足量金属钠反应放出11.2L H2
互为同分异构体
D . 1 mol该物质与足量金属钠反应放出11.2L H2





已知:①3Cl2+6NaOH5NaCl+NaClO3+3H2O
②2NaClO+(CNO)3H3=(CNO) 3Cl2Na+NaOH+H2O
回答下列问题:
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O=S4O
+2I-
实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是。
②该样品中有效氯含量的表达式为。(有效氯=100%)。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将(填“偏高”、“偏低”或“无影响”)。
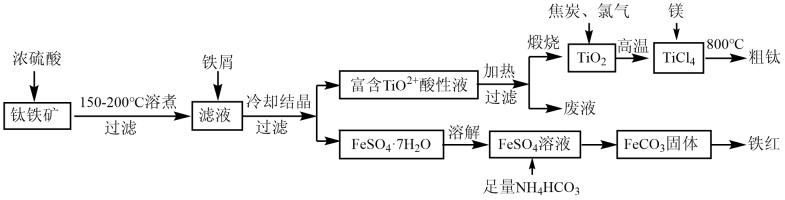
已知:①TiO2+易水解为TiO2·nH2O;高温下钛易与N2、H2等反应。
②常温下,Ksp [Fe(OH)2]=8.0×10-16 , Ksp[FeCO3]=3.2×10-11。
回答下列问题:
3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH1
3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) ΔH2
则反应:2CaSO4(s)+S(s)=2CaO(s)+3SO2(g) ,ΔH=(用ΔH1和ΔH2表示)。

①温度低于800℃时,主要的还原产物是一种硫的最低价盐,该物质的化学式是。
②1150℃下,向盛有足量CaSO4的真空恒容密闭容器中充入一定量CO,反应体系起始压强为0.1a MPa,主要发生反应:CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g)。该反应达到平衡时,c(SO2)=8.0×10-5mol·L-1 , CO的转化率为80%,则初始时c(CO)=mol·L-1 , 该反应的分压平衡常数KP=MPa(用含a的代数式表示;分压=总压×物质的量分数;忽略副反应)。


①该物质中含有的化学键类型有(填标号)。
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是。
 , 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。
, 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。

①不含-CH3 ②含2种官能团 ③含苯环,无其他环,且苯环上仅有2个取代基
其中核磁共振氢谱有三组峰,且峰面积之比为3:2:2的结构简式为。
 的合成路线 (其他必要的试剂自选)。
的合成路线 (其他必要的试剂自选)。